Modello atomico di storia di Rutherford, esperimenti, postulati
- 3950
- 316
- Dott. Rodolfo Gatti
Lui Modello atomico Rutherford È la descrizione dell'atomo creato dal fisico britannico Ernest Rutherford (1871-1937) quando nel 1911 scoprì il nucleo atomico, grazie ai famosi esperimenti di dispersione che si chiamano.
L'idea dell'atomo ("indivisibile"In greco) come la più piccola componente della materia, era una creazione intellettuale nata nell'antica Grecia, intorno a 300 a.C. Come tanti altri concetti greci, il concetto di atomo è sviluppato in base alla logica e all'argomentazione, ma non sulla sperimentazione.
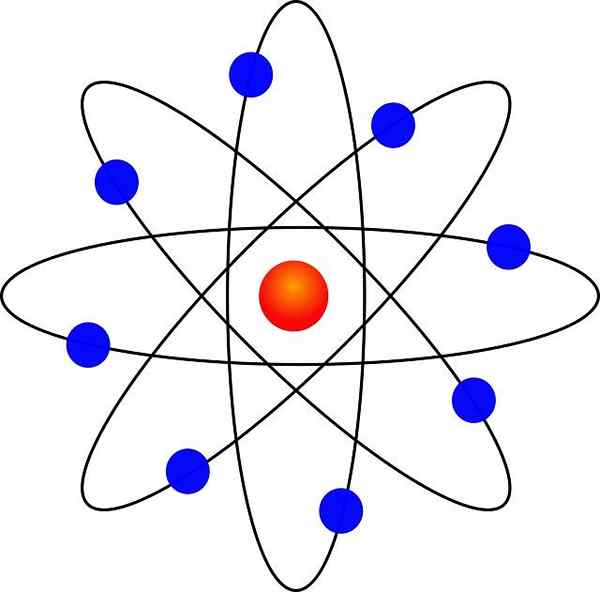
 Modello atomico Rutherford
Modello atomico Rutherford I filosofi atomisti più notevoli erano Democrito di Abdera (460 - 360 a.C.), Epicuro di Samos (341 - 270 AC) e Tito Lurrecio (98 - 54 AC). I Greci hanno concepito quattro diversi tipi di atomi che corrispondevano ai quattro elementi che secondo loro formavano la questione: aria, acqua, terra e fuoco.
Successivamente Aristotele avrebbe aggiunto un quinto elemento: l'etere che formava le stelle, poiché gli altri quattro elementi erano puramente terrestri.
Le conquiste di Alessandro Magno, di cui Aristotele era un insegnante, ampliarono le sue convinzioni per il mondo antico, dalla Spagna all'India e quindi, per secoli, l'idea di atomo Ha creato il suo posto nel mondo della scienza.
[TOC]
L'atomo cessa di essere indivisibile
Le idee dei filosofi greci sulla struttura dell'argomento furono mantenute come certe per centinaia di anni, fino a quando un chimico e insegnante inglese chiamato John Dalton (1776-1844) pubblicarono i risultati dei suoi esperimenti nel 1808.
Dalton ha convenuto che gli elementi sono costituiti da particelle estremamente piccole, chiamate atomi. Ma è andato oltre affermando che tutti gli atomi dello stesso elemento sono uguali, hanno le stesse dimensioni, la stessa massa e le stesse proprietà chimiche, il che li rende invariati durante una reazione chimica.
Questo è il primo modello atomico con una base scientifica. Come i Greci, Dalton ha continuato a considerare l'atomo come indivisibile, quindi privo di una struttura. Tuttavia, il genio di Dalton lo portò ad osservare uno dei grandi principi di conservazione della fisica:
- Nelle reazioni chimiche, Gli atomi non sono né creati né distrutti, Cambiano solo la loro distribuzione.
E stabilito il modo in cui i composti chimici erano formati da "atomi composti" (molecole):
- Quando due o più atomi di elementi diversi sono combinati per formare lo stesso composto, lo fanno sempre in proporzioni di massa definito e costante.
Il diciannovesimo secolo fu il grande secolo di elettricità e magnetismo. Alcuni anni dopo le pubblicazioni di Dalton, i risultati di alcuni esperimenti hanno seminato dubbi tra gli scienziati sull'indivisibilità dell'atomo.
Può servirti: qual è la reattanza capacitiva e come calcolarla?Crookes Tube
The Crookes Tube era un dispositivo progettato dal chimico e meteorologo britannico William Crookes (1832-1919). L'esperimento che Crookes ha condotto nel 1875, consisteva nel collocare, all'interno di un tubo pieno di gas a bassa pressione, due elettrodi, uno chiamato Catodo e un altro chiamato anodo.
Stabilendo una potenziale differenza tra i due elettrodi, il gas brillava con un colore che era caratteristico del gas utilizzato. Questo fatto ha suggerito che c'era una certa organizzazione particolare all'interno dell'atomo e che quindi non era indivisibile.
Inoltre, questa radiazione ha prodotto una fluorescenza debole nella parete del tubo di vetro davanti al catodo, tagliando l'ombra di un segno a forma di croce situato all'interno del tubo.
Era una radiazione misteriosa nota come "raggi catodici", che viaggiava in linea retta verso l'anodo e che era altamente energica, in grado di produrre effetti meccanici e che si è deviato verso una piastra caricata positivamente o anche da magneti.
La scoperta dell'elettrone
Le radiazioni all'interno del tubo di Crookes non potevano essere trattate, poiché aveva un carico negativo. Joseph John Thomson (1856-1940) trovò la risposta nel 1887 quando trovò la relazione tra il carico e la massa di questa radiazione e scoprì che era sempre lo stesso: 1.76 x 10undici C/kg., Indipendentemente dal gas bloccato nel tubo o nel materiale utilizzato per produrre il catodo.
Thomson ha chiamato queste particelle corpuscoli. Misurando la sua massa in relazione alla sua carica elettrica, ha concluso che ogni corpuscolo era molto più piccolo di un atomo. Pertanto, ha suggerito che dovrebbero farne parte, scoprendo così il elettrone.
Lo scienziato britannico fu il primo a delineare un modello grafico dell'atomo, attraverso il disegno di una sfera con punti inseriti, che per la sua forma fu data la denominazione di "Buddin of Ciruela". Ma questa scoperta ha portato altre domande:
- Se la questione è neutra e l'elettrone ha un carico negativo: in quale parte dell'atomo è il carico positivo che neutralizza gli elettroni?
- Se la massa elettronica è inferiore a quella dell'atomo, allora cosa consiste nel resto dell'atomo?
- Perché le particelle ottenute sono state sempre elettroni e mai di un altro tipo?
Esperimenti di dispersione di Rutherford: il nucleo atomico e il protone
Nel 1898 Rutherford aveva identificato due tipi di radiazioni dall'uranio, che chiamò alfa E beta.
La radioattività naturale era già stata scoperta da Marie Curie nel 1896. Le particelle alfa hanno un carico positivo e sono semplicemente nuclei di elio, ma a quel tempo il concetto di core non era ancora noto. Rutherford stava per scoprirlo.
Può servirti: sistema termodinamico: proprietà, tipi, esempiUno degli esperimenti che Rutherford ha fatto nel 1911 alla Manchester University, con l'assistenza di Hans Geiger, consisteva nel bombardare un foglio d'oro raffinato con particelle alfa, il cui carico è positivo. Intorno al foglio d'oro ha posizionato uno schermo fluorescente che ha permesso loro di visualizzare gli effetti del bombardamento.
Osservazioni
Studiando gli impatti sullo schermo fluorescente, Rutherford e i suoi assistenti hanno osservato che:
- Un'alta percentuale di particelle alfa ha attraversato il foglio senza deviazione evidente.
- Alcuni deviati ad angoli abbastanza pronunciati
- E molto poco rimbalzato all'indietro
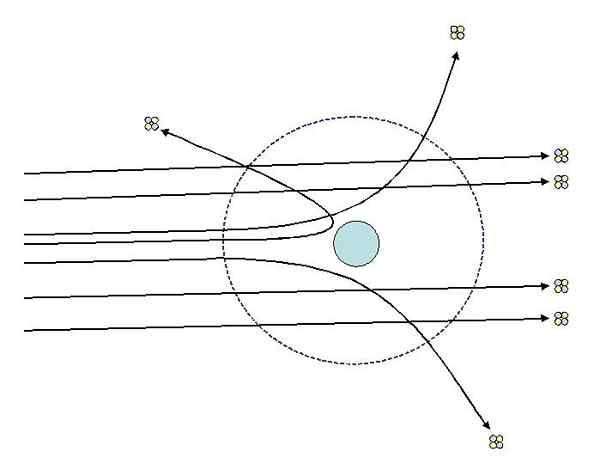 Esperimenti di dispersione di Rutherford. Fonte: [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]].
Esperimenti di dispersione di Rutherford. Fonte: [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]]. Le osservazioni 2 e 3 hanno sorpreso gli investigatori e li hanno portati ad assumere che la persona responsabile dei raggi dispersi dovrebbe avere una carica positiva e che in virtù dell'osservazione numero 1, quella persona responsabile aveva una dimensione molto più piccola di quella delle particelle di alfa.
Lo stesso Rutherford ha detto a questo proposito che era "... come se provassi un proiettile navale da 15 pollici contro un foglio di carta e il proiettile è rimbalzato e ti ha colpito". Questo potrebbe sicuramente essere spiegato dal modello Thompson.
Analizzando i suoi risultati dal classico punto di vista, Rutherford aveva scoperto l'esistenza del nucleo atomico, dove il carico positivo dell'atomo che ha dato a questa neutralità era concentrato.
Rutherford ha continuato con i suoi esperimenti di dispersione. Nel 1918 il nuovo bersaglio delle particelle alfa erano gli atomi di azoto gassoso.
In questo modo ha rilevato nuclei di idrogeno e ha subito saputo che l'unico sito da cui questi nuclei potevano provenire dallo stesso azoto. Come è stato possibile che i nuclei di idrogeno facessero parte dell'azoto?
Rutherford ha quindi suggerito che il nucleo di idrogeno, un elemento che era già stato assegnato il numero atomico 1, dovrebbe essere una particella fondamentale. la chiamo protone, Parola greca da designare Primo. Pertanto, le scoperte del nucleo atomico e del protone sono dovute a questo brillante neozyre.
Postula il modello atomico di Rutherford
Il nuovo modello era molto diverso da quello di Thompson. Questi erano i suoi postulati:
- L'atomo contiene un nucleo caricato positivamente, che nonostante sia molto piccolo, contiene quasi l'intera massa dell'atomo.
- Gli elettroni orbitano il nucleo atomico a grande distanza e in orbite circolari o ellittiche.
- Il carico netto dell'atomo è nullo, poiché le cariche degli elettroni compensano il carico positivo presente nel nucleo.
I calcoli di Rutherford hanno indicato un nucleo sferico e una radio piccola come 10-quindici m, essendo il valore del raggio atomico circa 100.000 volte più in alto, poiché i nuclei sono relativamente molto distanti l'uno dall'altro: dall'ordine di 10-10 M.
 Il giovane Ernest Rutherford. Fonte: sconosciuto, pubblicato nel 1939 a Rutherford: essere la vita e le lettere della RT. Hon. Lord Rutherford, o. M [cc per 4.0 (https: // creativeCommons.Org/licenze/by/4.0)]
Il giovane Ernest Rutherford. Fonte: sconosciuto, pubblicato nel 1939 a Rutherford: essere la vita e le lettere della RT. Hon. Lord Rutherford, o. M [cc per 4.0 (https: // creativeCommons.Org/licenze/by/4.0)] Questo spiega perché la maggior parte delle particelle alfa ha attraversato il foglio senza inconvenienti o appena sperimentato una deflessione molto piccola.
Visto agli oggetti di tutti i giorni, l'atomo di Rutherford sarebbe composto da un nucleo delle dimensioni di una palla da baseball, mentre il raggio atomico sarebbe di circa 8 km. Pertanto l'atomo può essere considerato quasi tutto come spazio vuoto.
Grazie alla sua somiglianza con un sistema solare in miniatura, era noto come "modello planetario dell'atomo". La forza di attrazione elettrostatica tra nucleo ed elettroni sarebbe analoga all'attrazione gravitazionale tra il sole e i pianeti.
Limitazioni
Tuttavia, ci sono stati alcuni disaccordi riguardo ad alcuni fatti osservati:
- Se l'idea che l'orbita elettronica attorno al nucleo sia accettata, succede che l'elettrone dovrebbe emettere continuamente radiazioni fino a quando non si scontra con il nucleo, con la conseguente distruzione dell'atomo in molto meno. Questo, per fortuna non è quello che succede davvero.
- Inoltre, in alcune occasioni l'atomo emette alcune frequenze delle radiazioni elettromagnetiche quando vi sono transizioni tra uno stato di maggiore energia a uno con meno energia, e solo quelle frequenze, non altre. Come spiegare il fatto che l'energia è quantizzata?
Nonostante questi limiti e che oggi ci sono modelli molto più sofisticati e secondo i fatti osservati, il modello atomico di Rutherford è ancora utile per lo studente per avere un primo approccio di successo sull'atomo e le sue particelle costituenti.
In questo modello dell'atomo, non appare il neutrone, un altro componente del nucleo, che non fu scoperto fino al 1932.
Poco tempo dopo che Rutherford propose il suo modello planetario, nel 1913 il fisico danese Niels Bohr lo avrebbe modificato per spiegare perché l'atomo non viene distrutto e siamo ancora qui per raccontare questa storia.
Articoli di interesse
Modello atomico di Schrödinger.
Broglie Atomic Model.
Modello atomico di Chadwick.
Modello atomico Heisenberg.
Modello atomico Perrin.
Modello atomico Thomson.
Modello atomico di Dirac Jordan.
Modello atomico di Democrito.
Modello atomico Bohr.
Modello atomico Dalton.
Riferimenti
- Rex, a. 2011. Fondamenti di fisica. Pearson. 618-621.
- Zapata, f. 2007. Note di classe per la radiobiologia e la sedia di protezione radiologica. Scuola di sanità pubblica dell'Università centrale del Venezuela.

