Caratteristiche del collegamento ionico, come forme ed esempi
- 4983
- 840
- Benedetta Rinaldi
Lui collegamento ionico È un tipo di legame chimico in cui esiste un'attrazione elettrostatica tra ioni con carico opposto. Cioè, uno ione caricato positivamente forma un collegamento con uno ione caricato negativamente, trasferendo elettroni da un atomo a un altro.
Questo tipo di legame chimico si verifica quando gli elettroni di valenza di un atomo vengono trasferiti permanentemente su un altro. L'atomo che perde elettroni diventa un catione (caricato positivamente) e colui che guadagna elettroni diventa un anione (caricato negativamente).
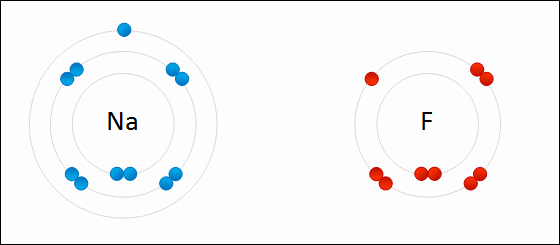
 Esempio di legame ionico: fluoruro di sodio. Il sodio perde un elettrone di Valencia e lo dà al fluoruro. WDCF [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Esempio di legame ionico: fluoruro di sodio. Il sodio perde un elettrone di Valencia e lo dà al fluoruro. WDCF [CC BY-S (https: // creativeCommons.Org/licenze/by-sa/3.0)] [TOC]
Concetto di collegamento ionico
Il legame ionico è quello con cui particelle caricate elettricamente, chiamate ioni, interagiscono per dare origine a solidi ionici e liquidi. Questo collegamento è il prodotto delle interazioni elettrostatiche tra centinaia di milioni di ioni e non è limitato solo a un paio di essi; Cioè, va oltre l'attrazione tra un onere positivo verso un carico negativo.
Considera ad esempio il cloruro di sodio composto ionico, NaCl, noto meglio come sale da tavola. Nel NaCl predomina il legame ionico, quindi è composto da ioni Na+ e cl-. Poi un+ È lo ione o il catione positivo, mentre il CL- (Cloruro) è lo ione o l'anione negativo.
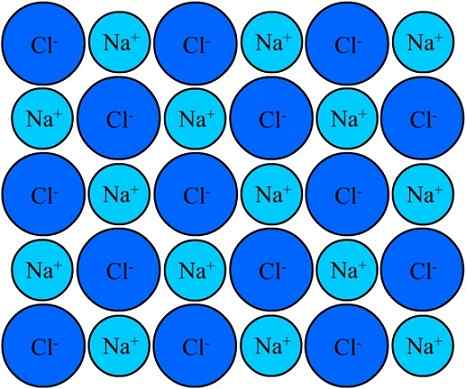 I cloruro di na+ e il cloruro di sodio rimangono uniti grazie al legame ionico. Fonte: Eyal Bairey via Wikipedia.
I cloruro di na+ e il cloruro di sodio rimangono uniti grazie al legame ionico. Fonte: Eyal Bairey via Wikipedia. Entrambi il na+ Come il Cl- Sono attratti per essere carichi elettrici opposti. Le distanze tra questi ioni consentono ad altri di avvicinarsi, in modo che appaia coppie e coppie NaCl. Na cationi+ Si respingeranno tra loro per essere di uguali carichi e lo stesso accade tra loro con gli anioni Cl-.
Arriva un momento in cui milioni di ioni Na+ e cl- Riescono a unificare, coeso, per originare una struttura il più stabile possibile; A governato dal collegamento ionico (immagine superiore). Na cationi+ Sono più piccoli degli anioni CL- A causa della crescente forza nucleare efficace del suo nucleo su elettroni esterni.
 Link ionico NaCl. RHANNOSH/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0)
Link ionico NaCl. RHANNOSH/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) Il legame ionico è caratterizzato dalla creazione di strutture ordinate in cui la distanza tra gli ioni (NA+ e cl- Nel caso di NaCl) è piccolo rispetto a quello di altri solidi. Si parla di una struttura cristallina ionica.
Com'è un collegamento ionico?
Il legame ionico avviene solo se si verifica una distribuzione elettronica in modo che si verifichino carichi ioni. Questo tipo di collegamento non può mai verificarsi tra particelle neutre. Ci devono essere necessariamente cationi e anioni. Ma da dove vengono?
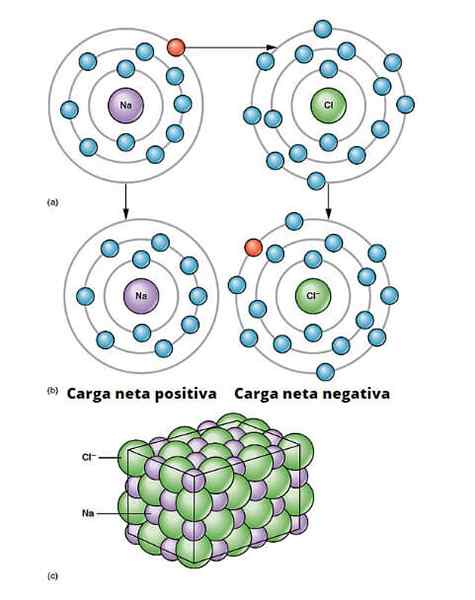 Illustrazione di collegamento ionico. a) Il sodio ha un carico netto negativo. b) Il sodio dà un elettrone al cloro. Il sodio è con un carico netto positivo e il cloro con carico netto negativo, generando il legame ionico. Questo tipo di legame tra milioni di atomi di Na e CL dà origine al sale fisico. OpenX College/CC di (https: // creativeCommons.Org/licenze/di/3.0)
Illustrazione di collegamento ionico. a) Il sodio ha un carico netto negativo. b) Il sodio dà un elettrone al cloro. Il sodio è con un carico netto positivo e il cloro con carico netto negativo, generando il legame ionico. Questo tipo di legame tra milioni di atomi di Na e CL dà origine al sale fisico. OpenX College/CC di (https: // creativeCommons.Org/licenze/di/3.0) Esistono molti modi per i quali provengono gli ioni, ma in sostanza molti si basano su una reazione di riduzione dell'ossidazione. La maggior parte dei composti ionici inorganici consistono in un elemento metallico con un elemento non metallico (quelli del blocco P della tabella periodica).
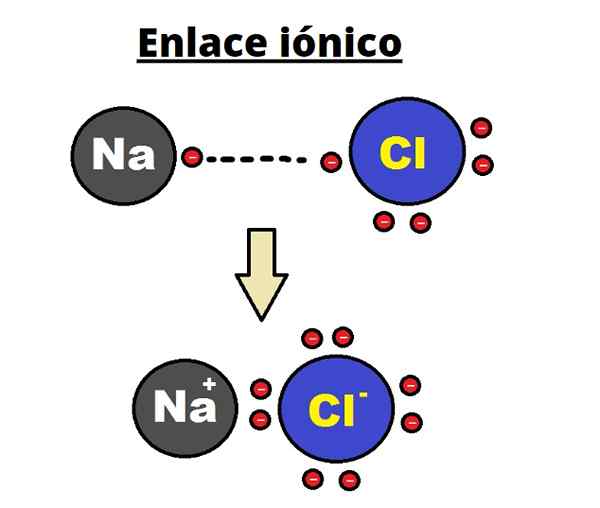
Il metallo deve ossidare, perdere elettroni, per trasformarsi in un catione. D'altra parte, l'elemento non metallico è ridotto, guadagna questi elettroni e diventa un anione. La seguente immagine illustra questo punto per la formazione di NaCl da atomi di sodio e cloro:
Può servirti: acido arsenico (H3SO4): proprietà, rischi e usi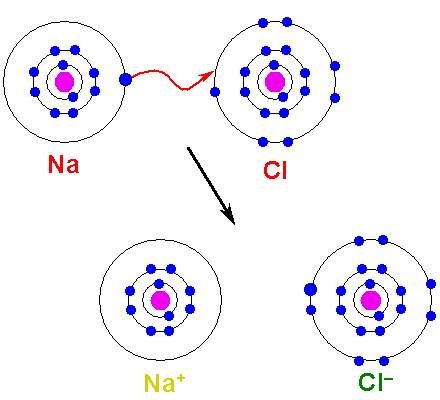 Formazione di un legame ionico. Fonte: Shafei in arabo Wikipedia / dominio pubblico
Formazione di un legame ionico. Fonte: Shafei in arabo Wikipedia / dominio pubblico L'atomo di NA dona uno dei suoi elettroni di Valencia al CL. Quando si verifica questa distribuzione elettronica, si formano ioni Na+ e cl-, che iniziano ad attrarre immediatamente ed elettrostaticamente.
Si dice quindi che na+ e cl- Non condividono alcun paio di elettroni, a differenza di quanto ci si potrebbe aspettare per un ipotetico legame covalente Na-Cl.
Proprietà del collegamento ionico
Il legame ionico non è indirezionale, cioè la sua forza non è presente in un'unica direzione, ma è propagata dallo spazio in base alle distanze che separano gli ioni. Questo fatto è importante, perché significa che gli ioni sono fortemente uniti, il che spiega alcune delle proprietà fisiche dei solidi ionici.
Punto di fusione
Il legame ionico è responsabile del sale a una temperatura di 801 ºC. Questa temperatura è considerevolmente alta rispetto ai punti di fusione di diversi metalli.
Questo perché NaCl deve assorbire abbastanza calore in modo che i suoi ioni inizino a fluire liberamente al di fuori dei loro cristalli; Cioè, le attrazioni tra NA devono essere superate+ e cl-.
Punto di ebollizione
I punti di fusione e ebollizione dei composti ionici sono particolarmente elevati delle loro forti interazioni elettrostatiche: il loro legame ionico. Tuttavia, poiché questo collegamento coinvolge molti ioni, questo comportamento viene generalmente assegnato alle forze intermolecolari e non correttamente al legame ionico.
Nel caso del sale, una volta che il NaCl è stato sciolto, si ottiene un liquido composto dagli stessi ioni iniziali; Solo ora si muovono con maggiore libertà. Il collegamento ionico è ancora presente. Na ioni+ e cl- Si incontrano sulla superficie del liquido per creare una grande tensione superficiale, che impedisce agli ioni di sfuggire alla fase gassosa.
Pertanto, il sale fuso deve aumentare ulteriormente la sua temperatura per bollire. Il punto di ebollizione di NaCl è 1465 ºC. A questa temperatura il calore supera le attrazioni tra Na+ e cl- Nel liquido, quindi i vapori di NaCl iniziano a formarsi con una pressione pari all'atmosfera.
Elettronegatività
In precedenza si diceva che il legame ionico si forma tra un elemento metallico e un elemento non metallico. In conti di riepilogo: tra un metallo e un non metal. Normalmente questo è in termini di composti ionici inorganici; Soprattutto, quelli di tipo binario, come NaCl.
Per la distribuzione di elettroni (NA+Cl-) e non una condivisione (Na-cl), deve esserci una grande differenza di elettronegatività tra i due atomi. Altrimenti, non ci sarebbe alcun legame ionico tra loro due. Forse l'approccio Na e CL, interagiscono, ma immediatamente il CL, per la sua maggiore elettronegatività, "strappa" un elettrone al NA.
Tuttavia, questo scenario si applica solo per i composti binari, MX, come NaCl. Per altri sali o composti ionici, i loro processi di formazione sono più complicati e non possono essere affrontati da una prospettiva semplicemente atomica o molecolare.
Può servirti: AlquinosRagazzi
Non esistono diversi tipi di legami ionici, poiché il fenomeno elettrostatico è puramente fisico, variando solo il modo in cui gli ioni interagiscono o il numero di atomi che possiedono; cioè, se sono ioni monoatomici o poliiatomici. Inoltre, ogni elemento o composto provoca uno ione caratteristico che definisce la natura del composto.
Nella sezione esempi, questo punto verrà approfondito e si vedrà che il legame ionico è lo stesso in sostanza in tutti i composti. Quando ciò non è soddisfatto, si dice che il legame ionico abbia un certo carattere covalente, che è il caso di molti metalli di transizione, in cui gli anioni sono coordinati con i cationi; Ad esempio, Fecl3 (Fede3+-Cl-).
Esempi di collegamenti ionici
Di seguito saranno elencati diversi composti ionici e le loro ioni e proporzioni saranno evidenziate:
- Cloruro di magnesio
MGCL2, (Mg2+Cl-), In una proporzione 1: 2 (mg2+: 2 Cl-)
- Fluoruro di potassio
Kf, (k+F-), In una proporzione 1: 1 (k+: F-)
- Solfuro di sodio
N / a2S, (na+S2-), In una proporzione 2: 1 (2 °+: S2-)
- Idrossido di lito
Lioh, (li+OH-), In una proporzione 1: 1 (li+: OH-)
- Fluoruro di calcio
CAF2, (AC2+F-), In una proporzione 1: 2 (CA2+: 2f-)
- Carbonato di sodio
N / a2Co3, (N / a+Co32-), In una proporzione 2: 1 (2 °+: Co32-)
- Carbonato di calcio
Ladro3, (AC2+Co32-), In una proporzione 1: 1 (CA2+: Co32-)
- Permanganato di Potassio
Kmno4, (K+MNE4-), In una proporzione 1: 1 (k+: Mn4-)
- Solfato di rame
Cuso4, (Cu2+SW42-), In una proporzione 1: 1 (Cu2+: COSÌ42-)
- Idrossido di bario
Ba (oh)2, (BA2+OH-), In una proporzione 1: 2 (BA2+: OH-)
- Bromuro di alluminio
Camice3, (Al3+Br-), in una proporzione 1: 3 a3+: 3br-)
- Ossido di ferro (III)
Fede2O3, (Fede3+O2-), In una proporzione 2: 3 (2fe3+: 32-)
- Ossido di stronzio
SRO, (SR2+O2-), In una proporzione 1: 1 (SR2+: O2-)
- Cloruro d'argento
AGCL, (AG+Cl-), In una proporzione 1: 1 (AG+: Cl-)
- Altri
-Cap3Cona, (scegli3COO-N / a+), In una proporzione 1: 1 (Cho3COO-: N / a+)
- NH4Io, (NH4+Yo-), In una proporzione 1: 1 (NH4+: Yo-)
Ognuno di questi composti presenta un legame ionico in cui milioni di ioni, corrispondenti alle loro formule chimiche, sono attratti elettrostaticamente e hanno origine un solido. Maggiore è la grandezza dei suoi carichi ionici, più intense sono le attrazioni e le repulsioni elettrostatiche.
Pertanto, un legame ionico tende ad essere più forte, più grandi sono le cariche degli ioni che compongono il composto.
Può servirti: alcheniEsercizi risolti
Alcuni esercizi che mettono la conoscenza di base del collegamento ionico saranno risolti di seguito.
- Esercizio 1
Quale dei seguenti composti è ionico? Le opzioni sono: hf, h2O, nah, h2S, NH3 e MgO.
Un composto ionico deve avere un legame ionico per definizione. Maggiore è la differenza nell'elettronegatività tra i suoi elementi componenti, maggiore è il carattere ionico di detto collegamento.
Pertanto, le opzioni che non hanno un elemento metallico vengono scartate in linea di principio: HF, H2O, h2S e nh3. Tutti questi composti sono formati solo da elementi non metallici. Il cation nh4+ È un'eccezione a questa regola, perché non ha metallo.
Le restanti opzioni sono NAH e MGO, che hanno rispettivamente metalli Na e Mg, uniti a elementi non metallici. Nah (na+H-) e mgo (mg2+O2-) Sono composti ionici.
- Esercizio 2
Considera il seguente ipotetico composto: AG (NH4)2Co3Yo. Quali sono i tuoi ioni e in quale proporzione sono solide?
Decomposizione del composto sui loro ioni che abbiamo: AG+, NH4+, Co32- e io-. Questi sono uniti elettrostaticamente seguendo la proporzione 1: 2: 1: 1 (AG+: 2nh4+: Co32-: Yo-). Significa che la quantità di cationi NH4+ È il doppio che per gli ioni Ag+, Co32- e io-.
- Esercizio 3
Quale dei seguenti composti ci si aspetterebbe in linea di principio che il legame ionico più forte aveva? Le opzioni sono: KBR, CAS, NA2SW4, CUO, ALPO4 e Pb3P4.
Il KBR è composto da K ioni+ e br-, Con una grandezza di carico. Quindi, CAS ha gli ioni CA2+ e s2-, Con carichi a doppia magnitudo, quindi si potrebbe pensare che il legame ionico in CA sia più forte che in KBR; E anche più forte che in na2SW4, Poiché quest'ultimo è composto da ioni Na+ E così42-.
Sia CAS che CUO possono avere un collegamento ionico forte uguale, poiché entrambi contengono ioni con carichi a doppia magnitudo. Quindi abbiamo Alpo4, con ioni al3+ e Po43-. Questi ioni hanno carichi di tripla magnitudo, quindi il collegamento ionico in ALPO4 Dovrebbe essere più forte che in tutte le opzioni di cui sopra.
E infine, abbiamo il vincitore PB3P4, Bene, se supponiamo che sia formato dagli ioni, diventano PB4+ E p3-. I loro carichi hanno le maggiori magnitudini; E quindi, PB3P4 È il composto che probabilmente ha il legame ionico più forte.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Legame ionico. Recuperato da: in.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11 febbraio 2020). Legami ionici vs covalenti - Comprendi la differenza. Recuperato da: Thoughtco.com
- I redattori di Enyclopedia Britannica. (31 gennaio 2020). Legame ionico. Encyclopædia Britannica. Recuperato da: Britannica.com
- Dizionario Chemicool. (2017). Definizione di legame ionico. Recuperato da: Chemicool.com
- « Caratteristiche di bilanciamento della granrataria, parti e come usarlo
- Modello atomico di storia di Rutherford, esperimenti, postulati »

