Modello atomico Bohr

- 3014
- 625
- Dott. Rodolfo Gatti
Lui Modello atomico Bohr È la concezione del fisico danese Niels Bohr (1885-1962) sulla struttura dell'atomo, pubblicato nel 1913. Nell'atomo di Bohr, gli elettroni attorno al nucleo occupano solo alcune orbite consentite, grazie a una restrizione chiamata quantizzazione.
Per Bohr, l'immagine dell'atomo come sistema solare in miniatura, con elettroni orbitanti attorno al nucleo, non era del tutto coerente con il fatto che le cariche elettriche, quando sono accelerate, irradiano energia.

Un atomo del genere non sarebbe stabile, perché finirebbe di crollare prima o poi perché gli elettroni avrebbero precipitato a spirale al nucleo. E a quel punto, 50 anni fa i modelli di luce caratteristici che emettono idrogeno e altri gas durante il riscaldamento.
Il modello o lo spettro è costituito da una serie di linee luminose di alcune lunghezze d'onda molto specifiche. E l'atomo di idrogeno non crolla emettendo la luce.
Per spiegare perché l'atomo è stabile nonostante sia in grado di irradiare energia elettromagnetica, Bohr ha proposto che il momento angolare potesse adottare solo determinati valori, e quindi anche l'energia. Questo è ciò che è compreso dalla quantizzazione.
Accettando che l'energia fosse quantizzata, l'elettrone avrebbe la stabilità necessaria per non correre verso il nucleo che distrugge l'atomo.
E l'atomo irradia solo energia luminosa quando l'elettrone effettua le transizioni da un'orbita all'altra, sempre in quantità discrete. In questo modo viene spiegata la presenza di schemi di emissione in idrogeno.
Bohr ha composto in questo modo una visione dell'atomo che integra concetti noti di meccanici classici con i nuovi scoperti, come la costante di Planck, il fotone, l'elettrone, il nucleo atomico (Rutherford era stato un mentore di Bohr) e gli spettri dimanti di questi.
[TOC]
Caratteristiche principali del modello Bohr
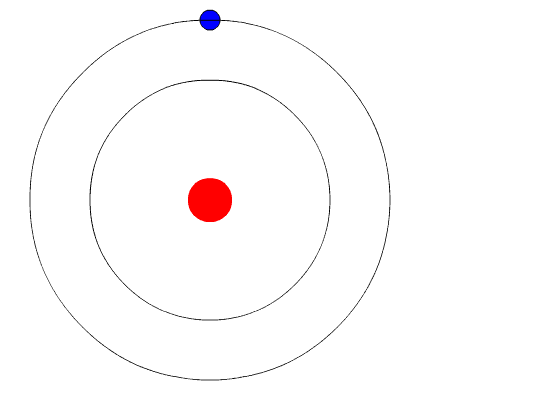 L'atomo di Bohr. L'animazione rappresenta l'elettrone quando passa da un livello più elevato di energia a un'altra meno energia, emettendo una luce di luce (un fotone). Fonte: Wikimedia Commons.
L'atomo di Bohr. L'animazione rappresenta l'elettrone quando passa da un livello più elevato di energia a un'altra meno energia, emettendo una luce di luce (un fotone). Fonte: Wikimedia Commons. Il modello atomico di Bohr presuppone che l'elettrone si muova in un'orbita circolare attorno al nucleo mediante l'azione dell'attrazione elettrostatica di Coulomb e propone che il momento angolare dell'elettrone sia quantizzato.
Può servirti: bilanciamento del vettore: calcolo, esempi, eserciziVediamo come integrare entrambi i concetti in forma matematica:
Sia la grandezza del momento angolare, la massa dell'elettrone e la velocità dell'elettrone e il raggio dell'orbita. Per calcolare L abbiamo:
L = m⋅R⋅v
Bohr propose che L era uguale a multipli interi della costante h/2π, dove h è il Planck costante, Introdotto poco tempo fa dal fisico Max Planck (1858-1947) nel risolvere il problema energetico emesso da un corpo nero, un oggetto teorico che assorbe tutta la luce incidente.
Il suo valore è h = 6.626 × 10−34 J ・ s, mentre a h/2π è indicato come H, Questo si legge "H bar".
Pertanto, il momento angolare L rimane:
m⋅R⋅v = nH, Con n = 1.2, 3 ..
E da questa condizione vengono dedotte le radio delle orbite consentite per l'elettrone, come vedremo allora.
Calcolo del raggio dell'orbita elettronica
In ciò che segue assumeremo il più semplice degli atomi: l'idrogeno, che consiste in un singolo protone e un elettrone, sia con un carico di magnitudo che.
La forza centripeta che mantiene l'elettrone nella sua orbita circolare è fornita dall'attrazione elettrostatica, la cui grandezza F è:
F = ke2/R2
Dove k è la costante elettrostatica della legge Coulomb e R la distanza elettronica-proteina. Sapendo che in un movimento circolare l'accelerazione centripetaC È dato dalla ragione tra il quadrato della velocità e la distanza R:
AC = v2 / R
Secondo la seconda legge di Newton, la forza netta è il prodotto della massa m per accelerazione:
MV2/r = ke2/R2
Si ottiene la radio RADIO R:
M⋅v2R = ke2
Combinando questa espressione con quella del momento angolare abbiamo un sistema di equazioni, dato da:
Può servirti: traiettoria fisica: caratteristiche, tipi, esempi ed esercizi1) Mv2R = ke2
2) r = n H/mv
L'idea è di risolvere il sistema e determinare r, il raggio dell'orbita consentita. Una piccola algebra elementare porta alla risposta:
R = (nH)2 / K⋅m⋅e2
Con n = 1, 2, 3, 4, 5 ..
Per n = 1 abbiamo l'ultimo delle radio, chiamate Bohr Radio aO Con un valore di 0,529 × 10−10 M. Le radio delle altre orbite sono espresse in termini di AO.
In questo modo Bohr introduce il numero quantico principale N, sottolineando che le radio consentite si basano sulla costante di Planck, sulla costante elettrostatica e sulla massa e sul carico dell'elettrone.
Il modello atomico bohr postula
 Fisico danese Niels Bohr (1885-1962).
Fisico danese Niels Bohr (1885-1962). Bohr combina abilmente i meccanici newtoniani con le nuove scoperte che avevano continuamente dato durante la seconda metà del XIX secolo e l'inizio del 20 ° secolo. Tra questi il concetto rivoluzionario di "quanto", di cui Planck stesso affermava di non essere molto convinto.
Attraverso la sua teoria, Bohr potrebbe spiegare in modo soddisfacente la serie dello spettro dell'idrogeno e prevedere le emissioni di energia nel rango di ultravioletto e infrarosso, che non era stato ancora osservato.
Possiamo riassumere i tuoi postulati come segue:
Gli elettroni descrivono le traiettorie circolari
L'elettrone ruota attorno al nucleo in orbita circolare stabile, con movimento circolare uniforme. Il movimento è dovuto all'attrazione elettrostatica che il nucleo esercita su di esso.
Il momento angolare è quantizzato
Il momento angolare dell'elettrone viene quantizzato in base all'espressione:
L = mvr = nH
Dove n è un numero intero: n = 1, 2, 3, 4 ..., che porta all'elettrone può essere solo in determinate orbite definite, le cui radio sono:
R = (n H)2 / k m e2
Gli elettroni emettono o assorbono i fotoni quando si spostano da uno stato energetico all'altro
 Quando si sposta da uno stato energetico all'altro, l'elettrone assorbe o emette energia in quantità discrete chiamate fotoni. Fonte: Wikimedia Commons.
Quando si sposta da uno stato energetico all'altro, l'elettrone assorbe o emette energia in quantità discrete chiamate fotoni. Fonte: Wikimedia Commons. Poiché il momento angolare è quantizzato, energia e anche. Si può dimostrare che E è dato da:
Può servirti: scatto verticale: formule, equazioni, esempi
L'elettrone Volt o EV, è un'altra unità per l'energia, ampiamente utilizzata nella fisica atomica. L'accesso negativo in energia garantisce la stabilità dell'orbita, indicando che dovrebbe essere svolto il lavoro per separare l'elettrone da questa posizione.
Mentre l'elettrone è nella sua orbita non assorbe o emette luce. Ma quando salta da un'orbita di maggiore energia a una più bassa, lo fa.
La frequenza F della luce emessa dipende dalla differenza tra i livelli di energia delle orbite:
E = HF = Einiziale - efinale
Limitazioni
Il modello Bohr ha alcune limitazioni:
-Si applica con successo solo all'atomo di idrogeno. I tentativi di applicarlo ad atomi più complessi non hanno funzionato.
-Non risponde perché alcune orbite sono stabili e altre no. Il fatto che l'energia nell'atomo sia stata quantizzata ha funzionato molto bene, ma il modello non ha fornito una ragione, ed è stato qualcosa che ha causato disagio agli scienziati.
-Un'altra limitazione importante è che non ha spiegato le linee aggiuntive emesse dagli atomi in presenza di campi elettromagnetici (effetto Zeeman ed effetto stark). O perché alcune linee di spettro erano più intense di altre.
-Il modello Bohr non considera gli effetti relativistici, il che è necessario.
-Dà per scontato che è possibile sapere con precisione la posizione e la velocità dell'elettrone, ma ciò che viene veramente calcolato è la probabilità che l'elettrone occupa una certa posizione.
Nonostante i suoi limiti, il modello ha avuto un grande successo all'epoca, non solo per l'integrazione di nuove scoperte con elementi già noti, ma perché ha mostrato nuove domande, rendendo chiaro che il percorso verso una spiegazione soddisfacente dell'atomo era nella meccanica quantistica.
Articoli di interesse
Modello atomico di Schrödinger.
Broglie Atomic Model.
Modello atomico di Chadwick.
Modello atomico Heisenberg.
Modello atomico Perrin.
Modello atomico Thomson.
Modello atomico Dalton.
Modello atomico di Dirac Jordan.
Modello atomico di Democrito.
Modello atomico Leucipo.
Modello atomico Sommerfeld.
Modello atomico attuale.


