Modello atomico attuale

- 1020
- 277
- Silvano Montanari
Qual è l'attuale modello atomico?
Lui Modello atomico attuale È quello basato sulla meccanica quantistica, in particolare nell'equazione di Schrödinger, nel principio di esclusione di Pauli e una proprietà dell'elettrone chiamato rotazione O Espin.
È il modello di maggiore accettazione e utilizzo nello studio della struttura di atomi, molecole e nella reattività chimica degli elementi, a causa della precisione delle loro previsioni e della loro relativa semplicità.
 Figura 1. Atomo di idrogeno in uno stato eccitato e i suoi numeri atomici: energia n = 4, momento angolare L = 3 e momento magnetico M = 1. Fonte: Wikimedia Commons.
Figura 1. Atomo di idrogeno in uno stato eccitato e i suoi numeri atomici: energia n = 4, momento angolare L = 3 e momento magnetico M = 1. Fonte: Wikimedia Commons. Questo modello è l'evoluzione di diversi modelli atomici precedenti, come il modello Rutherford e quello di Bohr - Sommerfeld, considerati modelli classici o semi -classici.
Esistono attualmente modelli teoricamente più completi del modello tipisico di Schrödinger, come il modello Dirac-Jordan, che incorpora una relatività speciale e si basa sull'equazione delle onde di Dirac. In questa equazione la rotazione, la proprietà degli elettroni menzionati all'inizio, appare naturalmente.
Ci sono anche modelli basati sulla teoria dei campi quantistici, applicati in fisica ad alta energia. Questi modelli sono eccellenti nella previsione della creazione e dell'annientamento di particelle fondamentali, l'obiettivo di questo campo di fisica.
Vale la pena ricordare che le teorie più sofisticate convergono agli stessi risultati di quelle dell'equazione di Schrödinger, in particolare per gli atomi di luce.
Caratteristiche del modello atomico corrente
Nella visione dell'attuale atomo, basato sul qua.
Tuttavia, l'immagine più diffusa dell'atomo è ancora quella di un nucleo centrale positivo e alcuni punti di carica elettrici negativi (elettroni), trasformando in orbite perfettamente definite intorno al nucleo centrale. Ma nonostante le sue radici, non corrisponde più all'attuale modello atomico.
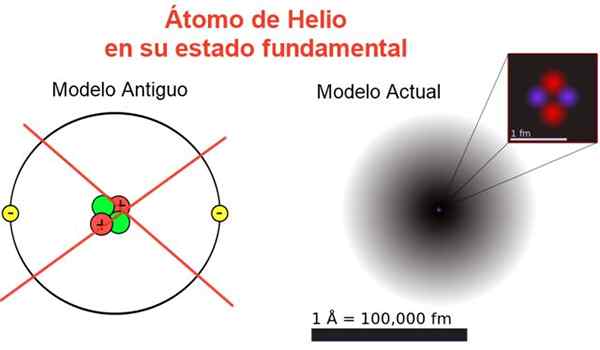 figura 2. Immagine classica e attuale dell'atomo di elio nel suo stato fondamentale. Nel modello attuale i due elettroni dell'atomo di elio sono sparsi in una regione chiamata orbitale. Fonte: Wikimedia Commons, la tua composizione.
figura 2. Immagine classica e attuale dell'atomo di elio nel suo stato fondamentale. Nel modello attuale i due elettroni dell'atomo di elio sono sparsi in una regione chiamata orbitale. Fonte: Wikimedia Commons, la tua composizione. La Figura 2 mostra la vecchia immagine e l'immagine corrente di un atomo di elio nel suo stato di energia più piccolo (livello n = 1 e l = 0).
Può servirti: accelerazione media: come viene calcolata e risoltaL'immagine classica è utile per vedere che il nucleo contiene due protoni e due neutroni. Garantire la neutralità dell'atomo ci sono due elettroni che occupano lo stesso livello di energia.
Dal resto è un'immagine lontano dalla realtà, poiché la scala del nucleo non corrisponde nemmeno a quella dell'atomo: il nucleo è 1/100000 volte le dimensioni dell'atomo, ma è qui che è concentrata la massa atomica.
Dualità onda - particella
La meccanica classica stabilisce che ogni particella materiale ha un'onda associata, chiamata Funzione d'onda. Questo è il famoso Dualità ONDA-particella da Louis de Broglie.
Nell'attuale modello atomico, il comportamento dell'elettrone sulla scala degli atomi è prominentemente ondulato, mentre a livello macroscopico, come gli elettroni che si muovono nei tubi dei raggi catodici dei vecchi televisori, il comportamento corpuscolare predomina.
D'altra parte, con i fotoni, succede al contrario, nella maggior parte dei fenomeni ottici (a livello macroscopico) hanno un comportamento fondamentalmente ondulatorio. E quando interagiscono con questioni di materia, hanno un comportamento di particelle.
Per questo motivo, gli elettroni attorno al nucleo sono sparsi in aree chiamate Orbitali atomici, la cui forma ed estensione dipenderanno dal livello di energia degli elettroni e dal momento angolare.
Sia l'energia che il momento angolare dell'elettrone attorno al nucleo hanno alcuni valori consentiti, quindi si dice che lo siano quantizzato.
L'equazione delle onde di Schrödinger prevede quali valori energetici e momento angolare sono consentiti, nonché la funzione d'onda associata a ciascun livello di energia e momento.
Il quadrato matematico della funzione d'onda determina gli orbitali, cioè le aree intorno al nucleo in cui gli elettroni possono essere trovati più probabili.
La dimensione dell'atomo
Per avere un'immagine in scala dell'attuale modello atomico, immaginiamo che un atomo abbia un diametro simile a quello di un campo di calcio. Il nucleo sarebbe come una formica al centro del campo, ma sorprendentemente con il 99,9% della massa atomica.
D'altra parte, gli elettroni sarebbero come giocatori spettrali diffusi in tutto il campo, con una maggiore probabilità di essere trovati a centrocampo.
Può servirti: variabile categorica: caratteristiche ed esempiCi sono alcuni allineamenti o modi ammessi per occupare il campo, che dipendono dall'energia dei giocatori (elettroni) e dalla quantità di "turno" o girare intorno al centro.
Postulato il modello atomico attuale
1.- L'elettrone è caratterizzato dalla sua massa m, dalla sua rotazione S E per essere la particella portante di carico negativo elementare (-e).
2.- Gli elettroni hanno un doppio comportamento a forma di onda, ma a seconda della loro energia e della scala del fenomeno può essere più preponderante dell'altro.
3.- Gli elettroni circondano il nucleo atomico positivo, in modo da garantire la neutralità elettrica dell'atomo. Pertanto, la quantità di elettroni è uguale a quella dei protoni; Questo è il numero atomico, che conferisce le caratteristiche chimiche e fisiche di ciascun elemento.
4.- L'interazione tra elettroni e nucleo è modellata da potenziale V (R) Electrostatic di Coulomb, che è incorporato nel termine potenziale energia nell'operatore hamiltoniano.
5.- Il termine dell'energia cinetica nell'operatore hamiltoniano è un operatore che è costruito dall'operatore del momento lineare, essendo lo stesso:
P = - i ħ ∂ /∂R
Dove ħ è la costante di Planck divisa per 2π.
6.- L'operatore hamiltoniano H = (P⋅p)/2m - e v (R) agire sulla funzione dell'onda elettronica ψ (R).
7.- Man mano che vengono ricercate le soluzioni stazionarie della funzione dell'onda elettronica, viene utilizzata l'equazione del tempo indipendente di Schrödinger:
H ψ (R) = E ψ (R)
Dove e rappresenta l'energia totale dell'elettrone.
8.- Negli atomi con diversi elettroni l'interazione tra loro non viene presa in considerazione.
9.- Quando si tratta di atomi di molti elettroni, gli orbitali degli elettroni più esterni sono modellati dal potenziale del nucleo schermato dai più elettroni interni, che è noto come potenziale Debye.
10.- L'equazione (7) ha una soluzione per alcuni valori energetici discreti, in modo che le celebrità Quanti da Planck, Appaiono naturalmente dalle soluzioni di equazione di Schrödinger.
Può servirti: onde stazionarie: formule, caratteristiche, tipi, esempiundici.- Per ogni valore discreto esiste una funzione d'onda. Ma alcune soluzioni sono degenerate, a seconda del valore del momento angolare L.
12.- La funzione d'onda è il prodotto di una funzione radiale, la funzione azimutale e la funzione polare.
13.- Questa funzione d'onda determina le regioni consentite per l'elettrone. Il quadrato della funzione d'onda è il densità di probabilità per trovare l'elettrone in una certa posizione, visto dal centro del nucleo atomico.
14.- Lo spin non appare nell'equazione di Schrödinger, ma è incorporato nel modello atomico attraverso il principio di Pauli:
L'elettrone è un fermione con due possibili stati di spin +½ e --½.
Quindi lo stesso stato caratterizzato da numeri quantici n, l, m dell'equazione di Schrödinger, può essere occupato al massimo da 2 elettroni con opposti opposti opposti. In questo modo l'espin diventa il quarto numero quantico.
Scienziati influenti nell'attuale modello atomico
Sembra incredibile, ma la maggior parte dei fisici che hanno contribuito all'attuale modello atomico appaiono nella stessa foto. Si sono radunati nelle famose conferenze sponsorizzate da Ernest Solvay, un chimico e industriale di origine belga, che è diventato famoso nel mondo della scienza.
Cominciarono ad essere trattenuti dal 1911 e riunivano i più grandi scienziati del momento, tra loro erano praticamente tutti coloro che hanno dato il loro contributo all'attuale modello atomico.
La più famosa di queste conferenze si tenne a Bruxelles nel 1927 e lì fu scattata questa fotografia storica:
 Figura 3. Partecipanti alla Conferenza Solvay 1927 a Bruxelles. Fonte: Wikimedia Commons.
Figura 3. Partecipanti alla Conferenza Solvay 1927 a Bruxelles. Fonte: Wikimedia Commons.  Figura 4. I partecipanti alla conferenza di Solvay 1927.
Figura 4. I partecipanti alla conferenza di Solvay 1927. - Peter Debye
- Irving Langmuir
- Martin Knudsen
- Auguste Piccard
- Max Planck
- William Lawrence Bragg
- Émile Henriot
- Paul Ehrenfest
- Marie Curie
- Hendrik Anthony Kramers
- Édouard Herzen
- Hendrik Antoon Lorentz
- Donder Théophile
- Paul Adrien Maurice Dirac
- Albert Einstein
- Erwin Schrödinger
- Arthur Holly Compton
- Jules-Temile Verschaffelt
- Paul Langevin
- Louis-Victor de Broglie
- Charles-Eugène Guye
- Wolfgang Pauli
- Werner Heisenberg
- Max nato
- Charles Thomson Rees Wilson
- Ralph Howard Fowler
- Léon Billouin
- Niels Bohr
- Owen Williams Richardson
Articoli di interesse
Modello atomico di Schrödinger.
Broglie Atomic Model.
Modello atomico di Chadwick.
Modello atomico Heisenberg.
Modello atomico Perrin.
Modello atomico Thomson.
Modello atomico Dalton.
Modello atomico di Dirac Jordan.
Modello atomico di Democrito.
Modello atomico Leucipo.
Modello atomico Bohr.
Riferimenti
- Alonso - Finn. Fondamenti quantici e statistici. Addison Wesley.
- Bauer, w. 2011. Fisica per ingegneria e scienze. Volume 1. Mc Graw Hill.
- Eisberg e Resnick. Fisica quantistica. Limusa - Wiley.
- Wikipedia. Teoria atomica. Recuperato da: è.Wikipedia.com
- Zapata f. Modello di atomo di atomo. Estratto da: Lifer.com

