Lipasa Caracateristic, Struttura, Tipi, Funzioni
- 1678
- 280
- Ruth Cattaneo
IL lipasas Costituiscono una grande famiglia di enzimi in grado di catalizzare l'idrolisi dei legami estere presenti in substrati come trigliceridi, fosfolipidi, esteri di colesterolo e alcune vitamine.
Sono presenti praticamente in tutti i regni della vita, sia in microrganismi, batteri e lieviti, come nelle piante e negli animali; In ogni tipo di organismo questi enzimi hanno proprietà e caratteristiche speciali che li differenziano l'uno dall'altro.
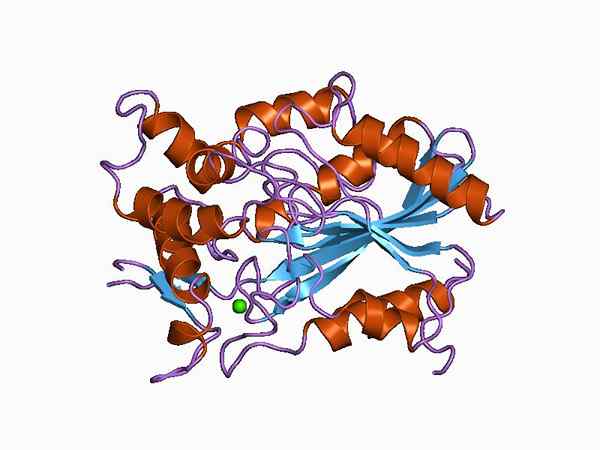
 Rappresentazione grafica della struttura molecolare di una lipasi (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Public Domain] tramite Wikimedia Commons)
Rappresentazione grafica della struttura molecolare di una lipasi (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Public Domain] tramite Wikimedia Commons) A seconda del tipo di classificazione, la distinzione può essere fatta tra le "vere" lipasas, note anche come lipas triacilglicerolo e altri enzimi con attività lipolitica simile come fosfolipasi, esterolo esterae e sito retinile-pealmitato.
Il primo rapporto pubblicato sulla sequenza di un'enzima lipasi fu quella di De Caro e collaboratori nel 1981, che studiò il triacilglicerolo lipasa pancreatico di suini. Studi successivi hanno dimostrato l'esistenza di molte altre lipasi sistemiche negli organismi viventi.
Le lipasi più importanti negli animali sono le lipasi digestive prodotte dal pancreas e dal fegato, che partecipano al metabolismo dei grassi consumati regolarmente nella dieta e quindi hanno importanti implicazioni fisiologiche da vari punti di vista.
Al momento, questi enzimi non sono solo studiati per scopi clinici e/o metabolici, ma producono anche industrialmente per scopi commerciali per la trasformazione degli alimenti e altri prodotti e possono essere ottenuti dalla coltivazione di microrganismi speciali.
[TOC]
Caratteristiche
Le lipasas sono proteine solubili in acqua e catalizzano le reazioni idrolitiche nei substrati insolubili. Si trovano in natura in un equilibrio tra la loro forma attiva e la loro forma inattiva e l'attivazione o l'inattivazione dipende da diversi fattori interni interni.
Può servirti: glucani: struttura, caratteristiche e funzioniAppartengono alla superfamiglia enzimatica dell'idrolisasi con pieghe α/β, in cui sono classificati tappetini, tioeterae, alcune proteasi e perossidasi, defalus e altre idrolasi intracellulari.
Le lipasi sono codificate da geni che appartengono a una famiglia che include i geni codificanti della lipasi pancreatica, la lipasi epatica, la lipasi lipoproteica, la lipasi endoteliale e la fosfatidilserina fosfolipasi A1.
Meccanismo catalitico
Alcuni autori propongono che la forma di catalisi che questi enzimi hanno sia analoga a quella delle proteasi, che è correlata alla presenza di tre rifiuti di aminoacidi speciali sul sito attivo.
Il meccanismo di idrolisi implica la formazione di un complesso enzimatico-substrato (lipasi: trigliceride), successivamente la formazione di un intermediario emiacetico e quindi il rilascio di un diacilgliceride e un acido grasso.
L'ultima fase di idrolisi, il rilascio di acido grasso dal sito attivo, si verifica da un modello noto come modello di "catapulta", che implica che dopo il clivaje o la rottura del legame estere, l'acido grasso viene rapidamente espulso dal sito catalitico.
Specificità del substrato
Le lipasi possono essere specifiche e distinguere tra substrati come trigliceridi, diacilgliceridi, monogliceridi e fosfolipidi. Alcuni sono specifici negli acidi grassi, cioè rispetto alla loro lunghezza, al loro grado di saturazione, ecc.
Possono anche essere selettivi in termini di regione in cui l'idrolisi catalizza, ciò significa che possono avere una specificità posizionale rispetto al sito in cui le molecole di acido grasso sono unite allo scheletro di glicerolo (in uno dei tre carboni).
Struttura
Così come gli altri membri della famiglia enzimatica a cui appartengono, le lipasi sono caratterizzate da una topologia composta da fogli α e β placcati. Il sito catalitico di questi enzimi è generalmente composto da una triade di aminoacidi: acido serina, aspartico o glutammico e istidina.
Può servirti: autopoiesiLa maggior parte delle lipasi sono glicoproteine che, a seconda delle dimensioni della porzione di carboidrati, hanno un peso molecolare tra 50 e 70 kDa.
Lipasi pancreatica umana
Ha 449 rifiuti di aminoacidi e due domini separati: un N-terminale, in cui il sito catalitico e la piega caratteristica delle idrolasi (α/β) e un altro C-terminale, più piccolo e più piccolo e considerato "ausiliario", con una struttura Chiamato "Sandwich β".
Il suo peso molecolare è compreso tra 45 e 53 kDa e la sua attività catalitica è maggiore a temperature vicino a 37 ° C e pH tra 6 e 10 e 10.
Funzioni
A seconda dell'organo in cui si trovano nei mammiferi, ad esempio, le lipasi esercitano funzioni fisiologiche in qualche modo diverse.
Come accennato, ci sono lipasas specifici nel pancreas, nel fegato, nelle ovaie e nelle ghiandole surrenali (nei reni) e nei tessuti endoteliali.
Le lipasi epatiche sono responsabili del metabolismo delle particelle lipoproteiche, che sono complesse formate da lipidi e proteine che funzionano principalmente nel trasporto di trigliceridi e colesterolo tra organi e tessuti.
In particolare, le lipasi partecipano all'idrolisi o al rilascio di acidi grassi dalle molecole di trigliceridi contenute nelle lipoproteine. Ciò è necessario per estrarre energia da queste molecole o per riciclarle, usandole come precursori nella sintesi di altri composti.
Le lipasi endoteliali sono presenti nel fegato, ai polmoni, alla tiroide e negli organi riproduttivi e l'espressione dei loro geni è regolata da diverse citochine. Questi enzimi partecipano anche al metabolismo delle lipoproteine.
Funzioni industriali
Nell'industria della produzione di alimenti lattiero -caseari, l'uso delle lipasi è comune per l'idrolizzamento dei grassi presenti nel latte, che ha effetti diretti sul "potenziamento" del sapore in formaggi, creme e altri prodotti lattiero -caseari.
Può servirti: gliceraldeide 3-fosfato (G3p): struttura, funzioniSono anche utilizzati nella produzione di altri prodotti alimentari, specialmente durante la fermentazione, al fine di migliorare il gusto e la "digeribilità" di alcuni pasti di preparazione alimentare.
Lontano dall'industria alimentare, l'uso di lipasi di origine microbica è popolare nella formulazione di detergenti e sostanze di pulizia generali, che riducono gli effetti deleteri sull'ambiente che comportano l'enorme carico chimico presente nei prodotti di pulizia convenzionali.
Riferimenti
- Lowe, m. E. (2002). Le lipasi trigliceridi del pancreas. Journal of Lipid Research, 43, 2007-2016.
- Mead, j. R., Irvine, s. A., & Ramji, D. P. (2002). Lipoproteina lipasi: struttura, funzione, regolazione e ruolo nella malattia. J. Mol. Med., 80, 753-769.
- Perret, b., Mabile, l., Martinez, l., Terzo, f., Barbaras, r., & Collet, x. (2002). Lipasi epatica: relazione struttura / funzione, sintesi e regolazione. Journal of Lipid Research, 43, 1163-1169.
- Santamarina-Fojo, s., González-Navarro, h., Freeman, l., Wagner, e., Santamarina-Fojo, s., Gonza, h.,... nong, z. (2004). Lipasi epatica, metabolismo delle lipoproteine e aterogenesi. Arteriosclerosi, trombosi e biologia vascolare, 24, 1750-1754.
- Taylor, p., Kurtovic, io., Marshall, s. N., Zhao, x., Simpson, b. K., Kurtovic, io.,... Zhao, x. Yo. N. (2012). Lipasi da mammiferi e pesci. Recensioni nella scienza della pesca, 29, 37-41.
- « Definizione, condizioni, esercizi dei vettori non coplanari
- Definizione, notazione, esercitazioni dei vettori di equipaggiamento »

