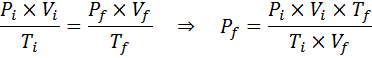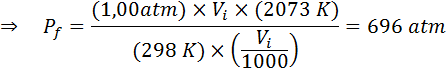Legge sui gas generali

- 4076
- 836
- Baldassarre Ross
Qual è la legge generale sul gas?
IL Legge sui gas generali, A volte chiamato anche la legge combinata dei gas, è la combinazione delle leggi di Boyle, Charles e Gay-Lussac. È una legge che descrive la relazione tra la pressione, la temperatura e il volume di una quantità fissa di un gas ideale.
La dichiarazione di questa legge dice:
“Se il numero di moli di un gas è costante, la relazione tra il volume di pressione e il prodotto di temperatura rimane costante."
In forma matematica, la legge generale dei gas è espressa come segue:
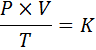
Dove p rappresenta la pressione del gas, v del suo volume, t la sua temperatura assoluta, e k è una costante di proporzionalità, il cui valore dipende sia dalla quantità di gas attuale che dalle unità in cui sono espresse le altre variabili.
Forme alternative della legge generale del gas
Come legge di proporzionalità
Un modo alternativo di enunciazione della legge generale dei gas è nella forma di una legge di proporzionalità:
"Per qualsiasi quantità fissa di gas, il prodotto della sua pressione e il suo volume è direttamente proporzionale alla temperatura".
Ciò significa che:
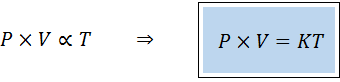
Ciò equivale a moltiplicare entrambi i membri della prima equazione per temperatura.
Relazione tra lo stato iniziale e finale
Come le leggi di Boyle, Charles e Gay-Lussac, la legge generale sul gas può essere espressa come una relazione tra lo stato iniziale e lo stato finale di un gas che subisce un cambio di stato.
A differenza delle leggi precedenti, non è necessario che nessuna delle tre variabili rimanga costante, solo il numero di moli. Vale a dire che il rapporto PXV/T sarà lo stesso nello stato iniziale, Yo, e nello stato finale, F. In altre parole, la legge generale sul gas può anche essere espressa matematicamente come:
Può servirti: acido píchric: cosa è, struttura, sintesi, proprietà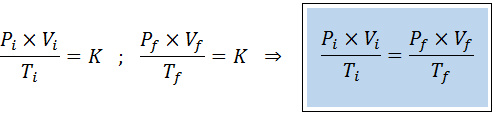
Derivazione della formula della legge generale del gas
Come accennato in precedenza, la legge generale sul gas viene dalla combinazione di Boyle, Charles e le leggi di Gay-Lussac. Queste leggi sono presentate di seguito:
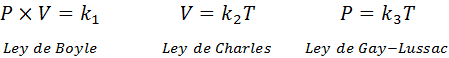
Se da ciascuna di queste leggi chiarisciamo la costante K, E poi li moltiplichiamo l'uno con l'altro, otteniamo:
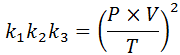
Ora, prendendo la radice quadrata in entrambi i membri, si ottiene la legge sul gas generale:
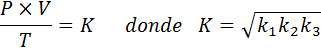
La legge generale dei gas vs. La legge dei gas ideali
La legge generale sui gas con la legge sui gas ideali non dovrebbe essere confusa. Nonostante sia due leggi molto simili e anche strettamente correlate, la legge generale sul gas combina solo le leggi di Boyle, Charles e Gay-Lussac.
Da parte sua, la legge Ideal Gases aggiunge il principio Avogadro, secondo il quale "Volumi uguali di gas diversi misurati nelle stesse condizioni di temperatura e pressione, contengono lo stesso numero di particelle ".
Di conseguenza, oltre a mettere in relazione la temperatura, il volume e la pressione, la legge del gas ideale consente anche a queste variabili di essere correlate al numero di particelle o alle moli di gas, quindi rappresenta l'equazione statale dello stato del Gas ideali.
Nelle seguenti equazioni, la differenza tra queste due leggi può essere osservata più facilmente:

Si noti che la differenza principale tra le due leggi è che la legge di gassa ideale include N, che rappresenta il numero di moli, e anche invece della costante K, ha La costante r che è la costante dei gas ideali.
Può servirti: terpenosPotremmo dire che la legge sui gas ideali è più generale della legge generale del gas, poiché può essere applicata per qualsiasi quantità di gas in qualsiasi set di condizioni di pressione, temperatura e volume. D'altra parte, l'applicazione della legge generale sul gas richiede che la quantità di gas rimanga costante.
Esempi dell'applicazione della legge generale del gas
Di seguito sono riportati alcuni esempi di problemi tipici in cui è possibile applicare la legge sul gas generale:
Esempio 1: una bolla d'aria sottomarina
Supponiamo che un sub a una profondità di 20 m sottoposti a acqua dove la pressione è di 3,00 atm e la temperatura è di 15 ° C rilascia un respiro d'aria e una delle bolle ha un volume iniziale di 100 cm3.
Determinare il volume della bolla d'aria quando raggiunge la superficie in condizioni di temperatura e pressione standard, supponendo che la quantità di aria all'interno della bolla non cambia man mano che aumenta.
Soluzione
Innanzitutto, dobbiamo estrarre tutti i dati dall'istruzione. Resta inteso che ci sono due stati diversi per il gas, una iniziale e un'estremità, quindi separiamo i dati in due gruppi. È inoltre necessario convertire le temperature a temperatura assoluta:

Poiché il problema specifica che non vi è alcuna modifica della quantità di gas (aria), quindi possiamo applicare la legge generale del gas, da cui possiamo cancellare il volume finale:
Può servirti: rodio: storia, proprietà, struttura, usi, rischio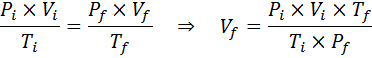
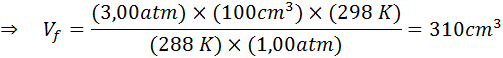
Pertanto, la bolla d'aria raggiunge un volume di 310 cm3 Dopo aver raggiunto la superficie.
Esempio 2: alta pressione
Quanto sarà la pressione di un gas ideale che è a una temperatura ambiente di 25 ° C e una pressione di 1,00 atm e comprimere il millesimo del suo volume allo stesso tempo calore fino a 1800 ° C in un contenitore sigillato?
Soluzione
Come prima, iniziamo estraendo i dati:

Come dice che il processo viene effettuato in un contenitore sigillato, la quantità di gas non cambia, quindi la legge generale del gas può essere applicata: