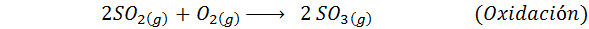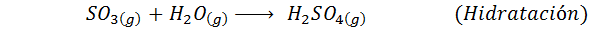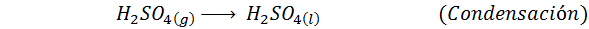Acido solforico (H2SO4)

- 2714
- 671
- Brigitta Ferrari
Spieghiamo quale acido solforico, la sua struttura chimica, le proprietà, il modo in cui è ottenuto, applicazioni e rischi di utilizzo
 Barche acido solforico (H2SO4)
Barche acido solforico (H2SO4) Cos'è l'acido solforico?
Lui acido solforico, Chiamato anche olio di idrogeno solfato e vetriolo, è un acido zolfo ossacidico formato dalla reazione di anidride solforica (così3) e acqua. La sua formula molecolare è h2SW4 Ed è di gran lunga il più prodotto e usato acido minerale.
È un acido minerale forte e altamente corrosivo che è miscibile con acqua, quindi può essere preparato sotto forma di soluzioni di quasi ogni concentrazione tra 0 e circa 18 molari.
The high volumes of production and consumption of this compound are due to its multiple applications in industries as varied as agriculture, the petrochemical industry, in organic and inorganic synthesis and in the treatment of wastewater, to name just some only some.
Struttura dell'acido solforico
L'acido solforico è formato da un atomo di zolfo centrale con Valencia VI che è circondato da 4 atomi di ossigeno, due dei quali sono collegati agli atomi di idrogeno. La sua struttura Lewis è presentata di seguito:
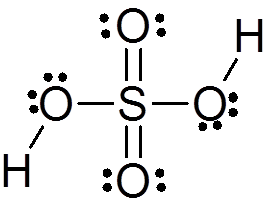
Come puoi vedere, lo zolfo in questo composto è circondato da 12 elettroni (6 coppie), quindi rappresenta una delle eccezioni della regola dell'ottetto.
Essendo circondati da 4 atomi, la teoria della repulsione delle coppie di elettroni di Valencia (Trepev) prevede che questo composto deve assumere una geometria approssimativamente tetraedrica, che è mostrata nella seguente immagine:
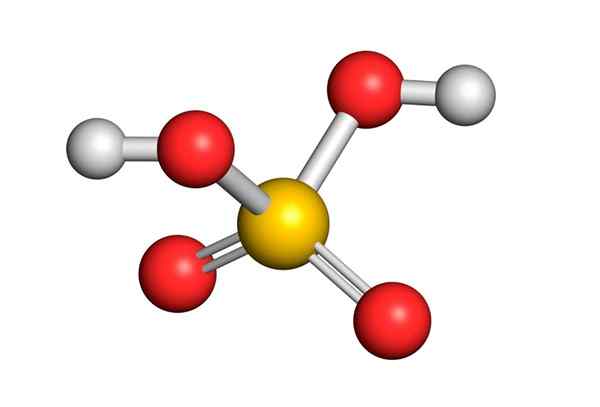
A causa dell'elevata elettronegatività dell'ossigeno e delle diverse strutture di risonanza che l'acido solforico può avere, i legami tra ossigeno e idrogeni sono fortemente polarizzati, il che li rende molto acidi e facili da dissociarsi.
Proprietà dell'acido solforico
Come conseguenza della sua struttura, l'acido solforico ha le seguenti proprietà fisiche e chimiche:
Può servirti: epossido: nomenclatura, ottenimento, applicazioni, esempiProprietà fisiche
- L'acido solforico puro è un liquido incolore e igienico che ha una densità di 1.8302 g/ml.
- Il suo punto di fusione è di 10,31 ° C e l'ebollizione è di 337 ° C, sebbene a quella temperatura tende a decomporsi per produrre acqua e anidride solforica (anche chiamata trioossido di zolfo).
- È completamente miscibile con l'acqua, quindi puoi preparare soluzioni con qualsiasi concentrazione. Tuttavia, le soluzioni con oltre il 98,3% in massa di questo acido sono instabili e l'acido si decompone fino a quando la sua concentrazione diminuisce al 98,3%. Questa soluzione è stabile ed è ciò che è noto come acido solforico concentrato.
- Nel suo stato puro o concentrato, è un liquido più viscoso dell'acqua.
Proprietà chimiche
- L'acido solforico puro è una sostanza fortemente ossidante e corrosiva. Ha la capacità di ossidare, disidratare e solfonare a un'ampia varietà di composti organici e carbonizzare altri.
- È un forte acido diprotico che perde completamente il suo primo protone dissolvendosi in acqua diventando così la sua base coniugata, lo ione bisolfato (HSO4-). Questo ione è anche un acido, sebbene più debole dell'acido originale.
- Le soluzioni acquose di acido solforico sono fortemente acide e sono in grado di dissolvere molti metalli, generando idrogeno gassoso. Sono anche in grado di neutralizzare completamente le basi forti.
- Reagisce violentemente con molti alcoli e acqua, rilasciando grandi quantità di calore nel processo.
Come viene ottenuto l'acido solforico?
I tre processi di produzione di acido solforico più noti sono: il processo di contatto, il processo di acido solforico a umido e il processo delle telecamere di piombo.
1. Sintesi dell'acido solforico da parte del processo di contatto
Questo è il metodo più usato oggi per produrre acido solforico. Il processo è composto da 5 passaggi in cui lo zolfo elementare diventa anidride dello zolfo (così2), quindi triossido di zolfo (così3), acido disulfurico (H2S2O7) e, infine, in acido solforico. Le reazioni coinvolte sono:
Può servirti: qual è il rombo di sicurezza e a cosa serve?
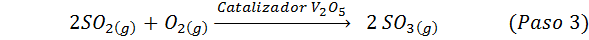


La seconda fase del processo consiste semplicemente nella purificazione dell'anidride solforosa prima di essere convertita in triossido di anidride solforica. La reazione del terzo passo si verifica quando l'anidride di zolfo gassosa entra in contatto con un catalizzatore di pentaossido di vanadio solido (V2O5), Ed è per questo che il metodo è chiamato processo di contatto.
2. Sintesi dell'acido solforico da parte del processo bagnato
Questo processo è stato progettato per purificare i gas di emissione di un'ampia varietà di industrie chimiche e piante. Il sottoprodotto di questa purificazione è l'acido solforico di grado commerciale oltre al vapore di acqua calda, che può essere riutilizzata nel processo industriale originale.
Nel caso del processo bagnato, le reazioni sono principalmente. Le reazioni importanti che si verificano in ogni fase sono:
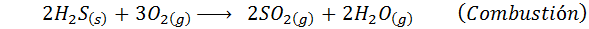
3. Sintesi dell'acido solforico mediante il processo delle telecamere di piombo
Questo è un metodo antico per produrre acido solforico che viene usato oggi molto poco. Il processo era quello di bruciare lo zolfo elementare in presenza di ossigeno d'aria nelle camere di legno ricoperte di piombo, e quindi il suo nome.
Dopo questa combustione, il biossido di zolfo reagisce quindi con gli ossidi di azoto prodotti dalla decomposizione del nitrato di sodio o con altri mezzi. Alla fine, dopo una serie di reazioni aggiuntive, è stato ottenuto l'acido solforico.
Può servirti: pallone di sfondo piattoApplicazioni comuni
- La principale applicazione di acido solforico è come fonte di zolfo sotto forma di solfati nella produzione di fertilizzanti. In effetti, circa il 60% dell'acido solforico prodotto nel mondo è destinato a questo scopo.
- Nell'industria chimica viene utilizzato per la sintesi di detergenti, pigmenti, catalizzatori per l'industria petrolchimica e nell'elaborazione dei minerali per ottenere diversi metalli.
- Infine, l'acido solforico è l'elettrolita usato nelle batterie di piombo utilizzate nella maggior parte delle auto.
Rischi associati all'acido solforico
A causa delle sue proprietà chimiche, l'acido solforico può essere molto pericoloso sia per gli esseri umani che per gli animali e l'ambiente in generale. Questi sono alcuni dei rischi associati a questa sostanza chimica:
- Le sue caratteristiche corrosive e disidratanti rendono l'acido puro causare gravi danni se viene a contatto con la pelle.
- D'altra parte, la reazione di soluzioni acquose di acido solforico con metalli genera idrogeno gassoso, che è una sostanza di combustibile ed esplosiva.
- L'acido solforico stesso non subisce una reazione di combustione, ma, essendo un forte ossidante, stimola la combustione di altre sostanze, agendo come una sorta di catalizzatore, quindi rappresenta un notevole rischio di incendio.
- Inoltre, se esposto al fuoco, può essere suddiviso in gas tossici e generare vapori di acido solforico che possono facilmente distruggere le vie aeree.
Per questi motivi e altro ancora, l'acido solforico è una sostanza che dovrebbe essere gestita attentamente.