Legge dei gas ideali formula e unità, applicazioni, esempi

- 2380
- 548
- Kayla Serr
IL Legge sui gas ideali È un'equazione statale che descrive una relazione tra le funzioni statali associate al gas ideale; come temperatura, pressione, volume e talpe. Questa legge consente di studiare sistemi gassosi reali confrontandoli con le versioni idealizzate.
Un gas ideale è un gas teorico, composto da particelle specifiche o sferiche che si muovono in modo casuale; Con grande energia cinetica, dove l'unica interazione tra loro sono scontri completamente elastici. Inoltre, rispettano la legge sul gas ideale.
 La legge sul gas ideale consente lo studio e la comprensione di molti sistemi gassosi reali. Fonte: pxhere.
La legge sul gas ideale consente lo studio e la comprensione di molti sistemi gassosi reali. Fonte: pxhere. A pressione e temperatura standard (STP): 1 atm di pressione e una temperatura di 0 ºC, la maggior parte dei gas reali si comporta qualitativamente come gas ideali; a condizione che le loro densità siano basse. Grandi distanze intermolecolari o interatomiche (per gas nobili) facilitano tali approcci.
In condizioni di STP ossigeno, azoto, idrogeno, gas nobili e alcuni gas composti, come l'anidride carbonica, si comportano come un gas ideale.
Il modello di gas ideale tende a fallire a basse temperature, pressioni elevate e densità di particelle elevate; Quando le interazioni intermolecolari, così come le dimensioni delle particelle, diventano importanti.
La legge Ideal Gases è una composizione di tre leggi di Gase: la legge di Boyle e Mariotte, la legge di Charles e Gay-Lussac e la legge di Avogadro.
[TOC]
Formula e unità

La legge dei gas è espressa matematicamente con la formula:
Pv = nrt
Dove p è la pressione esercitata da un gas. Di solito è espresso con l'unità atmosfera (ATM), sebbene possa essere espresso in altre unità: MMHG, Pascal, Bar, ecc.
Il volume V occupato dal gas è generalmente espresso con unità del litro (L). Mentre N È il numero di moli, r la costante universale dei gas e la temperatura espressa in Kelvin (K).
L'espressione più utilizzata nei gas R è equivalente a 0,08206 L · ATM · K-1· Mol-1. Sebbene l'unità per la costante di gas abbia un valore di 8.3145 J · mol-1· K-1. Entrambi sono validi fintanto che stanno attenti alle unità delle altre variabili (P, T e V).
La legge Ideal Gases è una combinazione della legge di Boyle-Maleotte, della legge di Charles-Gay-Lussac e della legge di Avogadro.
Legge di Boyle-Maleotte
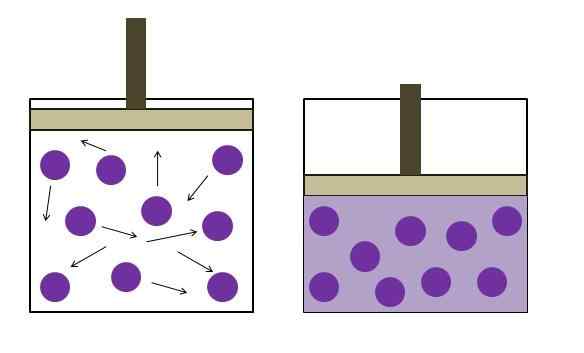 Aumento della pressione di riduzione della pressione. Fonte: Gabriel Bolívar
Aumento della pressione di riduzione della pressione. Fonte: Gabriel Bolívar Fu formulato indipendentemente dal fisico Robert Boyle (1662) e dal fisico e botanico Edme Mariotte (1676). La legge è dichiarata come segue: a una temperatura costante, il volume di una massa fissa di un gas è inversamente proporzionale alla pressione che esercita.
Può servirti: terpenosPV ∝ K
Usando due punti:
P1V1 = P2V2
Charles-Gay-Lussac Law
 Lanterne o desideri cinesi. Fonte: pxhere.
Lanterne o desideri cinesi. Fonte: pxhere. La legge fu pubblicata da Gay-Lussac nel 1803, ma riferita all'opera non pubblicata da Jacques Charles (1787). Per questo motivo la legge è conosciuta come la legge di Charles.
La legge stabilisce che a costante pressione esiste un rapporto diretto di proporzionalità tra il volume occupato da un gas e la sua temperatura.
V ∝ k2T
Usando due punti:
V1/T1 = V2/T2
V1T2 = V2T1
Legge Avogadro
La legge è stata dichiarata da Amadeo Avogadro nel 1811, rilevando che i volumi uguali di tutti i gas, alla stessa pressione e temperatura, hanno lo stesso numero di molecole.
V1/N1 = V2/N2
Ciò che stabilisce la legge sui gas ideali?
Attraverso la legge ideale sui gas, viene stabilita una relazione tra quattro proprietà fisiche indipendenti del gas: pressione, volume, temperatura e quantità di gas. È sufficiente conoscere il valore di tre di essi, al fine di ottenere quello del restante.
La legge stabilisce le condizioni che indicano quando un gas si comporta in modo ideale e quando si allontana da questo comportamento.
Ad esempio, il fattore di compressione così chiamato (PV/NRT) ha un valore di 1 per i gas ideali. Un valore del valore di 1 per il fattore di compressione, indica che il comportamento del gas si allontana dal gas ideale.
Pertanto, verrà commesso un errore quando si applica l'equazione di gas ideale a un gas che non si comporta secondo il modello.
Applicazioni
Calcolo della densità e della massa molare di un gas
L'equazione della legge sul gas ideale può essere utilizzata nel calcolo della densità di un gas e della sua massa molare. Quando si effettua una semplice modifica, è possibile trovare un'espressione matematica che riferisca la densità (d) di un gas e la sua massa molare (M):
D = mp/rt
E cancellare M:
M = drt/p
Calcolo del volume di un gas prodotto in una reazione chimica
La stechiometria è il ramo della chimica che mette in relazione la quantità di ciascuno dei reagenti presenti con i prodotti coinvolti in una reazione chimica, di solito espressa in moli.
L'uso dell'equazione di gas ideale consente la determinazione del volume di un gas prodotto in una reazione chimica; Poiché, dalla reazione chimica è possibile ottenere il numero di moli. Quindi, il volume del gas può essere calcolato:
Può servirti: ionomero di vetro: preparazione, proprietà, tipi, usiPv = nrt
V = nrt/p
La misurazione V può determinare le prestazioni o l'avanzamento di detta reazione. Quando non ci sono più gas, è indicativo che i reagenti siano completamente esauriti.
Calcolo delle pressioni parziali dei gas presenti in una miscela
La legge Ideal Gases può essere utilizzata, insieme alla legge parziale delle pressioni di Dalton, per calcolare le pressioni parziali dei diversi gas presenti in una miscela di gas.
La relazione viene applicata:
P = nrt/v
Per trovare la pressione di ciascuno dei gas presenti nella miscela.
Volume di gas raccolto in acqua
Viene fatta una reazione che produce un gas, che viene raccolto da un design sperimentale in acqua. La pressione totale del gas è nota più la pressione del vapore acqueo. Il valore di quest'ultimo può essere ottenuto in una tabella e mediante sottrazione può essere calcolata la pressione del gas.
Dalla stechiometria della reazione chimica, è possibile ottenere il numero di moli del gas e applicare la relazione:
V = nrt/p
Viene calcolato il volume del gas prodotto.
Esempi di calcoli
Esercizio 1
Un gas ha una densità da 0,0847 g/L a 17 ºC e una pressione di 760 torr. Qual è la tua massa molare? Cos'è il gas?
Iniziamo dall'equazione
M = drt/p
Per prima cosa convertiamo le unità di temperatura in Kelvin:
T = 17 ºC + 273,15 K = 290,15 K
E la pressione di 760 torr corrisponde a quella di 1 atm. Ora devi solo sostituire i valori e risolvere:
M = (0,0847 g/L) (0,08206 L · ATM · K-1· Mol-1) (290,15 K) / 1 ATM
M = 2.016 g/mol
Questa massa molare può corrispondere a una singola specie: la molecola di idrogeno diatomico, H2.
Esercizio 2
Una massa di 0,00553 g di mercurio (Hg) in una fase gassosa, è in un volume di 520 L e ad una temperatura di 507 K. Calcola la pressione esercitata dall'HG. La massa molare dell'HG è di 200,59 g/mol.
Il problema viene risolto usando l'equazione:
Pv = nrt
Non vengono visualizzate informazioni sul numero di moli di Hg; Ma possono essere ottenuti usando la loro massa molare:
Moli di Hg = (0,00553 g di Hg) (1 mol Hg/200,59 g)
Può servirti: ossigeno: proprietà, struttura, rischi, usi= 2.757 · 10-5 Talpe
Ora dobbiamo solo cancellare P e sostituire i valori:
P = nrt/v
= (2.757 · 10-5 talpe) (8.206 · 10-2 L · atm · k-1· Mol-1) (507 K)/ 520 L
= 2.2 · 10-6 ATM
Esercizio 3
Calcola la pressione generata dall'acido cloridrico prodotto reagendo 4,8 g di gas di cloro (CL2) con idrogeno gas (H2), In un volume di 5,25 L e ad una temperatura di 310 K. La massa molare del CL2 è 70,9 g/mol.
H2 g) + Cl2 g) → 2 HCl(G)
Il problema viene risolto utilizzando l'equazione di gas ideale. Ma la quantità di HCl è espressa in grammi e non in moli, quindi viene effettuata la trasformazione dovuta.
Moli di hcl = (4,8 g cl2) (1 mol di CL2/70,9 g cl2) (2 mol di HCl/1Mol di CL2)
= 0,135 moli di HCl
Applicare l'equazione della legge sui gas ideali:
Pv = nrt
P = nrt/v
= (0,135 moli di HCl) (0,08206 L · ATM · K-1· Mol-1) (310 K) / 5.25 L
= 0,65 atm
Esercizio 4
Un campione di 0,130 g di un composto gassoso occupa un volume di 140 ml a una temperatura di 70 ºC e ad una pressione di 720 torr. Qual è la tua massa molare?
Per applicare l'equazione di Gase ideale, diverse modifiche devono prima apportare:
V = (140 ml) (1 l/1000 ml)
= 0,14 l
Avere il volume in litri, ora devi esprimere la temperatura in Kelvin:
T = 70 ºC + 273,15 K = 243,15 K
E infine, dobbiamo trasformare la pressione in unità di atmosfera:
P = (720 Torr) (1 atm/760 Torr)
= 0.947 atm
Il primo passo per risolvere il problema è ottenere il numero di moli dal composto. Per questo, viene utilizzata l'equazione dei gas ideali e abbiamo eliminato N:
Pv = nrt
N = pv / rt
= (0,947 atm) (0,14 L) / (0,08206 L · ATM · K-1· Mol-1) (243.15 K)
= 0,067 talpe
È necessario solo calcolare l'impasto molare dividendo i grammi tra le moli ottenute:
Massa molare = grammi del composto / numero di moli.
= 0,130 g / 0,067 moli
= 19,49 g/mol
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Iran. Levine. (2014). Principi di fisica. Sesta edizione. Mc Graw Hill.
- Glalasstone. (1970). Trattato di chimica fisica. Seconda edizione. Aguilar.
- Mathews, c. K., Van Holde, K. E., E Ahern, K. G. (2002). Biochimica. 3era Edizione. Editoriale di Pearson Addison Wesley.
- Wikipedia. (2019). Gas ideale. Recuperato da: in.Wikipedia.org
- Team editoriale. (2018). Boyle Law o Boyle-Maleotte Law | Leggi sul gas. Recuperato da: iquimicas.com
- Jessie a. Chiave. (S.F.). La legge ideale per il gas e le sub applicazioni. Estratto da: OpenTextbc.AC
- « Tradizioni culturali dell'Arabia Saudita, costumi, gastronomia
- Circuito produttivo delle fasi principali della carne »

