La legge di Fick
- 3050
- 202
- Benedetta Rinaldi
Cos'è la legge di Fick?
IL La legge di Fick È un'equazione matematica che mette in relazione il flusso di massa diffuso in un mezzo con le concentrazioni o il gradiente di pressione. Fu formulato nel 1855 dal fisiologo e medico tedesco Adolf Fick, ispirato dalle leggi di Fourier (conduzione termica) e OHM (conduzione elettrica), modellava il processo di diffusione dell'ossigeno agli alveoli dei polmoni.
La legge di Fick presenta la particolarità che non è solo applicabile ai fenomeni di diffusione chimica o biochimica, ma a quelli di qualsiasi tipo di natura. Pertanto, serve a modellare la diffusione degli atomi tra solidi, essendo molto utile nella fisica dei materiali e dell'ingegneria.
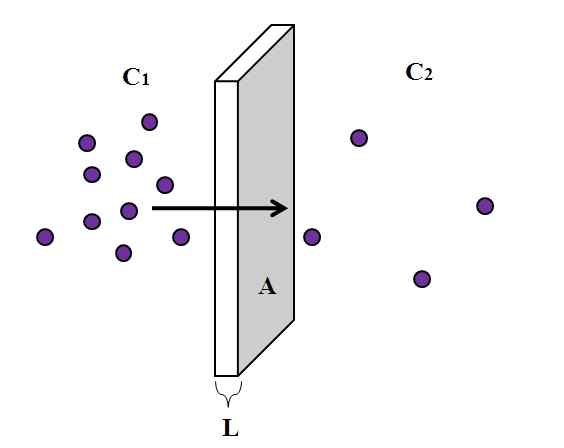
 Rappresentazione di un processo di diffusione attraverso una membrana semipermeabile. Fonte: Gabriel Bolívar.
Rappresentazione di un processo di diffusione attraverso una membrana semipermeabile. Fonte: Gabriel Bolívar. Tuttavia, la base centrale è la stessa per quasi tutti i fenomeni di diffusione, che è illustrato sopra. Le particelle viola, essere atomi o molecole, sono diffuse attraverso una membrana spessa semipermeabile L e un'area trasversale. A sinistra abbiamo una concentrazione maggiore C1 di particelle che a destra, c2.
La legge di Fick stabilisce quanto segue: il flusso di massa che viene diffuso attraverso una superficie è proporzionale al gradiente di concentrazione (c2-C1/L) e una costante d chiamata coefficiente di diffusione o diffusività.
Questa legge ha due forme: una basata sullo spazio (x) e un'altra a seconda dello spazio e del tempo (x, t). Il primo vale per i sistemi in condizioni stazionarie, mentre il secondo per i sistemi reali e non stazionari.
La prima legge di Fick
Componenti ed equazioni
La spessa l della membrana semipermeabile rappresenta la distanza (x) che le particelle devono viaggiare per raggiungere l'altro lato. Come si può vedere nell'immagine, particelle viola più si allontanano dal compartimento sinistro, dove c1 È fantastico, la sua concentrazione diminuisce al valore di C2. Cioè, la concentrazione cambia lungo lo spessore della membrana, dipendente da x.
Questa variazione di concentrazione a seconda della distanza è ciò che è noto come gradiente di concentrazione: (c2-C1)/L o (c2-C1)/X. Si noti che il suo valore è negativo (-1), perché c2 > C1.
D'altra parte, abbiamo anche la velocità con cui le particelle sono diffuse attraverso la membrana o lo spazio in questione. Questa velocità dipende dalle dimensioni e dalla massa delle particelle, nonché dalla natura dell'ambiente e della temperatura. Il coefficiente di diffusione D rappresenta questa velocità e può essere costante o meno durante la diffusione.
Può servirti: filtro di laboratorio): caratteristiche, funzioni, tipiE infine, abbiamo un flusso di massa "J" che attraversa l'area trasversale della membrana o il canale in cui si diffondono le particelle. Raggruppando questi termini, nasce l'equazione della prima legge di Fick:
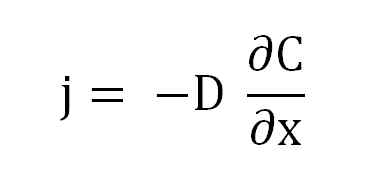 Equazione della prima legge di Fick. Fonte: Gabriel Bolívar.
Equazione della prima legge di Fick. Fonte: Gabriel Bolívar. Dove j è proporzionale a d e a (∂c/∂x), il gradiente di concentrazione.
Interpretazione e unità
Il simbolo negativo nell'equazione serve a neutralizzare il segno negativo del gradiente delle concentrazioni. Altrimenti, J avrebbe un valore negativo, che non è più lontano. Allo stesso modo, il valore di d è positivo, in modo che moltiplicando per il segno negativo che lo precede, dà un valore negativo.
La prima legge di Fick indica quanto segue: maggiore è il gradiente di concentrazione (∂c/∂x), maggiore è il flusso di massa j. Cioè, la differenza tra C2 e C1 Diventa più grande e, quindi, più particelle si diffondono attraverso la membrana.
D'altra parte, J dipende anche da D, che a sua volta dipende da parametri come temperatura, viscosità, peso molecolare e area trasversale a:
D ∝ (a/l) (s/√mW)
Dove s è la solubilità della particella che si diffonde con l'ambiente e mW Il suo peso molecolare.
Per quanto riguarda le unità dei componenti o i termini dell'equazione che abbiamo:
-C (kg · m-3 o mol · m-3)
-D (m-2· S-1)
-J (kg · m-2· S-1 o mol · m-2· S-1)
Spostamento quadratico medio netto
Durante la diffusione le particelle si scontrano tra loro e dopo brevi intervalli di tempo finiscono per viaggiare enormi distanze ΔX. Tuttavia, a seconda del significato di questi spostamenti, ΔX può avere valori negativi o positivi (secondo un punto di origine). Ecco perché la media dei valori Δx per tutte le molecole tende a 0.
D'altra parte, i valori ΔX sono molto piccoli rispetto alle distanze che eseguono le particelle. Quando si scontrano, perdono la mobilità verso una direzione, di conseguenza con uno spostamento netto limitato; Ad esempio, 2 cm avanzano in una direzione dopo aver viaggiato centinaia di metri in collisioni e rimbalzi.
Einstein nel 1905 trovò un'espressione matematica per la pergamena media dello spostamento (quindi diverso da 0):
<(Δx)2> = 2dt
Definizione
(Δx)RMS ≡ <(Δx)2>1/2 = (2dt)1/2
(Δx)RMS È lo spostamento quadratico netto medio delle particelle in questione. (Δx)RMS Ci dice quante particelle si muovono in media (in una direzione positiva o negativa) in base al tempo. Alcune particelle si muoveranno ulteriormente o più vicine a distanze di (Δx)RMS, causando una distribuzione gaussiana.
Può servirti: ossido di calcio (CAO)Fick Second Law
Equazione
La prima legge di Fick descrive la diffusione in condizioni stazionarie, cioè il flusso di massa J non varia nel tempo. Nei sistemi reali, tuttavia, abbiamo condizioni non stazionarie, in cui il flusso di massa non solo varia nello spazio, ma anche nel tempo. Pertanto, è interessato a determinare (∂c/∂t).
Di seguito abbiamo due equazioni che rappresentano la seconda legge di Fick:
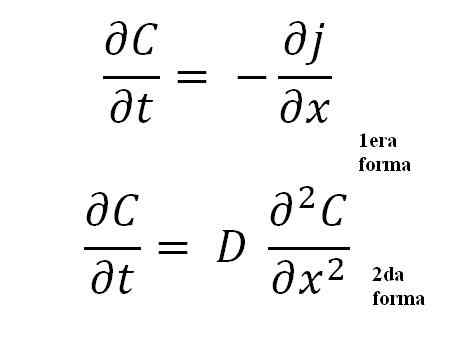 Equazioni della seconda legge di Fick. Fonte: Gabriel Bolívar.
Equazioni della seconda legge di Fick. Fonte: Gabriel Bolívar. La seconda forma è la più importante di tutte, in quanto rappresenta l'equazione matematica generale per qualsiasi processo di diffusione; sia termico, elettrico, atomico, ecc.
Deduzione
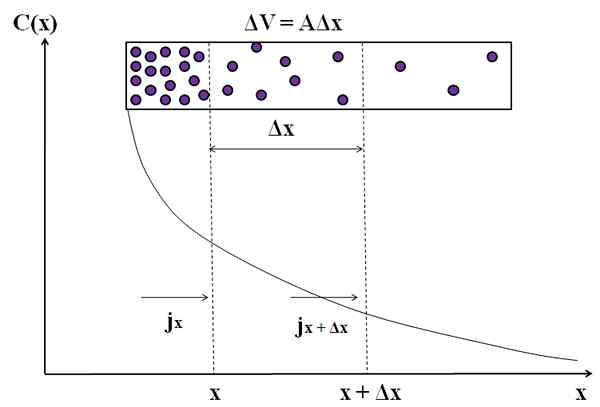 Rappresentazione grafica di come il flusso di massa non è costante nella diffusione di queste molecole. Fonte: Gabriel Bolívar.
Rappresentazione grafica di come il flusso di massa non è costante nella diffusione di queste molecole. Fonte: Gabriel Bolívar. Considera di nuovo particelle viola in una camera rettangolare. Tra le distanze x e x+Δx abbiamo un flusso jX (in arrivo) e Jx+Δx (in uscita). Il volume della fotocamera tra queste distanze è definito da:
ΔV = aΔx
Si noti che il grafico C (x) vs x non ha origine una linea retta, quindi abbiamo valori diversi di j (jX ≠ jx+Δx). Dobbiamo determinare Δc/Δt.
La massa mX Sarà uguale a:
MX = JX AΔt
Un'analisi dimensionale aiuta a capire perché:
kg = (kg · m-2· S-1) (M2) (S)
Allo stesso modo calcoliamo Mx+Δx:
Mx+ Δx = Jx+Δx AΔt
Essere la massa che si accumula in quella regione pari a Δm:
ΔM = mX - Mx+ Δx
= (jX - Jx+ Δx) AΔt
= -(jx+ Δx - JX) AΔt
= -ΔjaΔt
E sapendo che ΔC = ΔM/ΔV
ΔC = -ΔJAΔT/ ΔV
= -ΔjaΔt /aΔx
= -ΔJΔT/ΔX
Canciamo ΔC/ΔT
ΔC/ΔT = -ΔJ/ΔX
Questa espressione indica che la variazione della concentrazione nel tempo è uguale alla variazione del flusso J rispetto al suo spostamento. Applicare i limiti per ΔT e ΔX che tendono a 0 otteniamo la stessa espressione di un derivato parziale:
∂c/∂t = -(∂j/∂x) (1a forma)
Infine, la seconda forma si ottiene sostituendo J con la prima legge di Fick:
∂c/∂t = -∂/∂x (-d∂c/∂x)
= D (∂2C/∂x2) (2a forma)
Esercizi risolti
Nei seguenti esercizi, verranno considerati sistemi molto semplici i cui incogniti possono essere risolti usando la prima legge di Fick.
Esercizio 1
Dichiarazione
In un tubo lungo 15 metri di larghezza e 21 centimetri e che è anche satura di azoto, una corrente di ossigeno viene diffusa da un'estremità all'altra a una temperatura di 0 ºC. Sapendo che la pressione sul lato sinistro (P1) è 20 kg/m3, E che la pressione sul lato destro (P2) è 10 kg, determina:
Può servirti: ioni idronioa) Il flusso di massa che è diffuso
b) quanti chilogrammi di o2 Si diffondono attraverso il tubo in 17 minuti?
c) il gradiente di concentrazione o le pressioni
d) la pressione di O2 A una distanza di 7 metri dall'ingresso alla conduttura
e) quanto saranno 80 kg di o2 Nel diffondersi attraverso questo tubo?
Considera che dO2-N2 è uguale a 1.8 · 10-5 M2· S-1.
Risoluzione
Dalla prima legge di Fick dobbiamo risolvere la sottosezione a):
J = -d (p2-P1)/L
= -(1.8 · 10-5 M2· S-1) (10-20) (kg/m3)/(15 m)
= 1.2 · 10-5 kg · m-2· S-1
A b) abbiamo bisogno dell'area del tubo:
A = π (0.21 m)2
= 0.14 m2
E moltiplichiamo J per un tempo t per determinare la massa di o2 Disperso:
MO2 = (1.2 · 10-5 kg · m-2· S-1) (17 s) (0.14 m2)
= 3.57 · 10-5 kg
Ora, per la sottosezione c) abbiamo che il gradiente è uguale a:
Gradiente = (p2-P1)/L
= (10-20) (kg/m3)/15 m
= -2/3 (kg/m3) · M-1
Ma prendiamo il valore positivo, il che ha senso fisico:
2/3 (kg/m3) · M-1
Questo valore ci servirà quindi a risolvere la sottosezione d) Se il gradiente viene interpretato bene: ogni misuratore della pressione di o2 2/3 kg/m cadranno3. Diffondendo 7 metri che avremo:
2/3 (kg/m3) · M-1 (7 m) = 14/3 o 4.7 kg/m3
Cioè, la pressione a quella distanza sarà:
(20-4.7) (kg/m3) = 15.3 kg/m3
E infine, la sottosezione E) è simile a b), solo che ora chiarisciamo il tempo e non la massa:
MO2 = Jat
t = mO2/Ja
= (80 kg)/(1.2 · 10-5 kg · m-2· S-1) (0.14 m2)
= 47619.04 s o 0.55 giorni
Esercizio 2
Dichiarazione
Determina (Δx)RMS Per saccarosio in acqua a t = 1 minuto, 1 ora e 1 giorno. Il coefficiente di diffusione del saccarosio in acqua è 0.52 · 10-5cm2· S-1.
Risoluzione
Applichiamo l'equazione:
(Δx)RMS ≡ <(Δx)2>1/2 = (2dt)1/2
Valutiamo (Δx)RMS Con i tempi espressi in pochi secondi. Per t = 1 min o 60 s:
(Δx)RMS = ((2 (0.52 · 10-5cm2· S-1) (60s))1/2
= 0.025 cm
Per t = 1 h o 3600 s:
(Δx)RMS = ((2 (0.52 · 10-5cm2· S-1) (3600s))1/2
= 0.19 cm
E infine per t = 1 giorno o 86400 s:
(Δx)RMS = ((2 (0.52 · 10-5cm2· S-1) (86400s))1/2
= 0.95 cm
Si noti che col passare del tempo le molecole di saccarosio non sono nemmeno state in grado di spostare 1 cm in nessuna direzione.
Riferimenti
- Walter J. Moore. (1963). Chimica fisica. In cinetica chimica. Quarta edizione, Longmans.
- Iran. Levine. (2009). Principi di fisica. Sesta edizione. Mc Graw Hill.
- Introduzione alla scienza dei materiali e all'ingegneria. (11 marzo 2018). La seconda legge di Fick. Prof. Rajesh Prasad. [VIDEO]. Recuperato da: YouTube.com
- Wikipedia. (2020). Le leggi di diffusione di Fick. Recuperato da: in.Wikipedia.org
- Laura Dickson. (10 settembre 2020). DIFFUSIONE. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Larissa Zhou et al. (1 settembre 2015). Comprensione della teoria della diffusione e della legge di Fick attraverso il cibo e la cucina. L'American Physiological Society. doi.org/10.1152/Advan.00133.2014

