Boyle Law
- 1652
- 185
- Benedetta Rinaldi
Qual è la legge di Boyle?
IL Legge di Law Boyle o Boyle-Maleotte È uno che esprime la relazione tra la pressione esercitata da o su un gas e il volume che questo occupa; Mantenere costantemente la temperatura del gas, sia la sua quantità (numero di moli).
Questa legge, insieme a quella di Charles, Gay-Lussac, Charles e Avogadro, descrive il comportamento di un gas ideale; In particolare, in un contenitore chiuso soggetto a variazioni di volume esercitate da una forza meccanica.
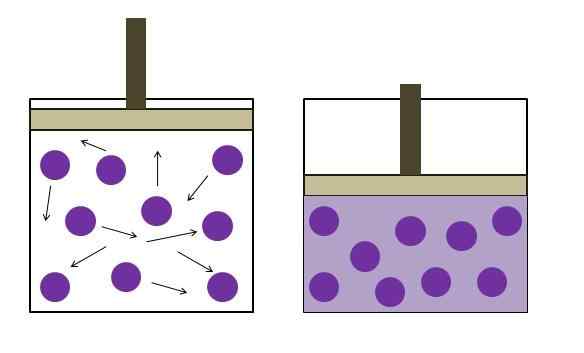
 Aumento della pressione di riduzione della pressione. Fonte: Gabriel Bolívar
Aumento della pressione di riduzione della pressione. Fonte: Gabriel Bolívar L'immagine superiore riassume brevemente la legge di Boyle. I punti viola rappresentano molecole o atomi di gas, che si scontrano con le pareti interne del contenitore (a sinistra). Diminendo lo spazio disponibile o il volume del contenitore occupato da questo gas, le collisioni sono aumentate, il che si traduce in un aumento della pressione (a destra).
Ciò dimostra che la pressione P e Volume V del gas è inversamente proporzionale se il contenitore è strettamente chiuso; Altrimenti, una maggiore pressione sarebbe uguale a una maggiore dilatazione del contenitore.
Se si osservasse un grafico V contro P, con i dati di V e P sugli assi e e X, rispettivamente, sarebbe osservata una curva asintotica. Maggiore è V, maggiore è l'aumento di P; Cioè, la curva si estenderà verso alti valori di p sull'asse x.
Naturalmente, la temperatura rimane costante; Ma, se lo stesso esperimento fosse condotto a temperature diverse, le posizioni relative di queste curve v vs p cambierebbero sull'asse cartesiano. Il cambiamento sarebbe ancora più evidente se fossero grafici su un asse a tre dimensioni, con costante t sull'asse z.
Storia della legge di Boyle
Sfondo
Poiché lo scienziato Galileo Galilei ha espresso la sua convinzione nell'esistenza del vuoto (1638), gli scienziati hanno iniziato a studiare le proprietà dell'aria e delle lacune parziali.
Il chimico angloirlandico, Robert Boyle, iniziò il suo studio sulle proprietà aeree nel 1638 dopo aver appreso che Otto von Guericke, ingegnere tedesco e ingegnere fisico, aveva costruito una bomba aerea.
Può servirti: bromo: storia, struttura, configurazione elettronica, proprietà, usiEsperimento di mercurio
Per eseguire gli studi sulla pressione dell'aria, Boyle ha usato un tubo di forma "J", la cui costruzione è stata attribuita a Robert Hooke, un assistente di Boyle. L'estremità del braccio corto è stata sigillata, mentre l'estremità del braccio lungo del tubo era aperta per posizionare il mercurio.
Fin dall'inizio, Boyle voleva studiare l'elasticità dell'aria, qualitativamente e quantitativamente. Quando il mercurio si riversò attraverso l'estremità aperta del tubo sotto forma di "J", Boyle dedusse che l'aria nel braccio corto del tubo era contratta sotto la pressione di Mercurio.
Risultati
Maggiore è la quantità di mercurio aggiunta al tubo, maggiore è la pressione esercitata sull'aria e più basso è il volume. Boyle ha ottenuto un grafico esponenziale negativo del volume dell'aria a seconda della pressione.
Nel frattempo, se viene tracciato il volume dell'aria contro la pressione inversa, c'è una linea retta di pendenza positiva.
Nel 1662, Boyle pubblicò la prima legge fisica che fu data sotto forma di equazione, che indicava la dipendenza funzionale di due variabili. In questo caso, pressione e volume.
Boyle ha detto che c'era una relazione inversa tra la pressione esercitata su un gas e il volume occupato quel gas, questa relazione relativamente vera per i gas reali è. La maggior parte dei gas si comporta come gas ideali per moderare pressioni e temperature.
Quando si verificano pressioni più elevate e temperature più basse, le deviazioni dal comportamento dei gas reali degli ideali sono diventate più notevoli.
Edme Mariotte
Il fisico francese Edme Mariotte (1620-1684) scoprì indipendentemente la stessa legge nel 1679. Ma aveva il merito di dimostrare che il volume varia con la temperatura. Ecco perché si chiama legge o legge di Mariotte di Boyle e Mariotte.
Rafforzamento della legge
Daniel Bernoulli (1737) ha rafforzato la legge di Boyle sottolineando che la pressione di un gas è prodotta dagli impatti delle particelle di gas sulle pareti del contenitore che lo contengono.
Può servirti: nucleofilo: attacco nucleofilo, tipi, esempi, nucleofiliaNel 1845, John Waterston pubblicò un articolo scientifico, che si concentra sui principi principali della teoria cinetica dei gas.
Successivamente, Rudolf Clausius, James Maxwell e Ludqwig Boltzmann hanno consolidato la teoria cinetica dei gas, che mette in relazione la pressione esercitata da un gas con la velocità delle particelle di gas in movimento in movimento.
Più basso è il volume del contenitore contenente un gas, maggiore è la frequenza degli impatti delle particelle che lo formano contro le pareti del contenitore; E quindi, maggiore è la pressione esercitata dal gas.
Cos'è questa legge?
Gli esperimenti condotti da Boyle, sottolineano che esiste una relazione inversa tra il volume occupato da un gas e la pressione esercitata su di esso. Tuttavia, la relazione di cui sopra non è totalmente lineare, come indicato da un grafico di variazione del volume in base alla pressione attribuita a Boyle.
Nella legge di Boyle è indicato che il volume occupato da un gas è inversamente proporzionale alla pressione. È inoltre indicato che il prodotto della pressione di un gas per il suo volume è costante.
Espressione matematica
Per arrivare all'espressione matematica della legge di Boyle, inizia da:
V ∝ 1/p
Dove indica che il volume occupato da un gas è inversamente proporzionale alla sua pressione. Tuttavia, esiste una costante che impone quanto sia inversamente proporzionale questa relazione.
V = k/p
Dove k è la costante di proporzionalità. Clearing K che hai:
VP = k
Il prodotto della pressione di un gas per il suo volume è costante. COSÌ:
V1P1 = K e v2P2 = k
E questo può essere dedotto che:
V1P1 = V2P2
Quest'ultimo è l'espressione o l'equazione finale per la legge di Boyle.
Cosa serve? Quali problemi risolve la legge di Boyle?
Motori a vapore
La legge di Boyle-Maleotte viene applicata nel funzionamento delle macchine a vapore. È un motore a combustione esterna che utilizza la trasformazione dell'energia termica di una quantità di acqua in energia meccanica.
L'acqua viene riscaldata in una caldaia strettamente chiusa e il vapore prodotto esercita pressione secondo la legge di Boyle che produce un'espansione di un volume del cilindro spingendo un pistone.
Può servirti: fattore di diluizioneIl movimento lineare del pistone si trasforma in un movimento di rotazione, usando un sistema di manovelle e manovella, che può guidare le ruote di una locomotiva o il rotore di un generatore elettrico.
Sorseggiare bevande
L'azione di aspirare una soda o un succo di una bottiglia attraverso un tubo di plastica è legata alla legge di Boyle. Quando l'aria del tubo viene suggerita usando la bocca, c'è una diminuzione della pressione all'interno del tubo.
Questa caduta di pressione facilita il movimento ascendente del fluido nel tubo, permettendo la sua ingestione. Lo stesso principio funziona nell'estrazione del sangue usando una siringa.
Sistema respiratorio
La legge di Boyle è strettamente correlata al funzionamento del sistema respiratorio. Durante la fase di ispirazione, si verifica la contrazione del diaframma e di altri muscoli; Ad esempio, intercostali esterni che producono un'espansione della gabbia toracica.
Ciò provoca una diminuzione della pressione intrapleurica, causando un'espansione polmonare che produce un aumento del volume polmonare. Pertanto, la pressione intrapolmonare diminuisce in base a quanto aumentato nella legge di Boyle.
Diventando subatosio la pressione intrapolmonare, l'aria atmosferica scorre nei polmoni, che produce un aumento della pressione nei polmoni; abbinando così la sua pressione alla pressione atmosferica e conclude la fase di ispirazione.
Successivamente, i muscoli inspiratori si rilassano e il contratto dei muscoli espirativi. Inoltre, viene prodotta la retrazione polmonare elastica, un fenomeno che produce una diminuzione del volume polmonare, con un conseguente aumento della pressione intrapolmonare, spiegabile dalla legge di Boyle.
Aumentando la pressione intrapolmonare e diventando maggiore della pressione atmosferica, l'aria scorre all'interno dei polmoni verso l'atmosfera. Ciò si verifica fino a quando le pressioni sono uguali, che conclude la fase di scadenza.
Riferimenti
- La legge di Boyle. Encyclopædia Britannica. Recuperato da: Britannica.com
- La formula per la legge di Boyle. Recuperato da: Thoughtco.com

