Legge Avogadro
- 1913
- 49
- Dante Morelli
Qual è la legge di Avogadro?
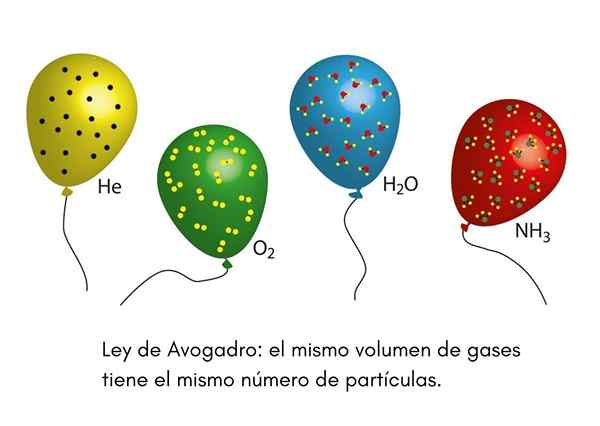
IL Legge Avogadro, Chiamato anche principio di Avogadro, è una legge che si applica ai gas ideali ed è stata enunciata da uno scienziato del diciannovesimo secolo chiamato Amadeo Avogadro. Questa legge stabilisce che due volumi uguali di gas diversi che si trovano nelle stesse condizioni di temperatura e pressione, conterranno lo stesso numero di particelle gassose.
Ciò significa che, se abbiamo due palloncini, uno pieno di elio e l'altro con ossigeno, ed entrambi i palloncini hanno lo stesso volume, la stessa pressione e la stessa temperatura, allora ci sarà lo stesso numero di atomi di elio gassosi nel primo Globe che le molecole di ossigeno nel secondo.
Formula di legge Avogadro
Un altro modo per dichiarare la legge di Avogadro è dire che, se vengono mantenute la pressione e la temperatura costanti, il volume di un gas sarà proporzionale al numero di moli. Questo è rappresentato in modo matematico come:
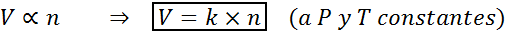
Questa formula può essere riorganizzata in v/n = k, cioè che la relazione tra il volume e il numero di moli rimane costante ogni volta che p e t sono costanti.
Pertanto, se introduciamo o rimuoviamo una certa quantità di gas da un contenitore che mantiene costante p e t, il volume cambierà e lo stato iniziale e finale sarà correlato per mezzo della seguente equazione:

Condizioni in base alle quali viene soddisfatta la legge di Avogadro
Questa legge si applica esattamente ai gas ideali. Questi sono gas formati da particelle specifiche (che non occupano un volume nello spazio) che non interagiscono tra loro in alcun modo.
Può servirti: biodiesel: storia, proprietà, tipi, vantaggi, svantaggiCome suggerisce il nome, questo tipo di gassa non esiste nella realtà ma nella nostra immaginazione. Sono un'idea semplificata di ciò che crediamo sia un gas. Tuttavia, ci sono alcune condizioni in cui un gas reale, come l'aria, si comporta idealmente: a pressioni molto basse e a temperature molto elevate.
Le basse pressioni causano trascurabili il volume occupato dalle particelle di gas rispetto alle dimensioni del contenitore, mentre le alte temperature fanno muovere le particelle così velocemente da non avere il tempo di interagire quando si incrociano l'una con l'altra.
In queste condizioni, la maggior parte dei gas incontra la legge di Avogadro con buona precisione.
Importanza della legge di Avogadro
Uno dei contributi più importanti della legge di Avogadro è stato che ha permesso di dimostrare l'esistenza di gas elementari formati da più di un atomo come O2 o h2. Ciò ha contribuito all'avanzamento della teoria atomica.
Inoltre, la legge di Avogadro completa le leggi di Boyle, Charles e Gay-Lussac e combinandola con queste tre leggi, la legge di Avogadro consente la legge dei gas ideali, una delle leggi più importanti in chimica.
D'altra parte, la legge di Avogadro consente anche di stabilire relazioni tra pesi molecolari di gas diversi, poiché implica che la massa di volumi uguali di gas diversi misurati alla stessa temperatura e pressione, è proporzionale alla massa di ciascuna particella di ciascun gas.
Può servirti: nitrato di sodio (nano3): struttura, proprietà, usi, rischiQuindi, con singoli campioni di rimpianto di due gas che occupano volumi pari alla stessa temperatura e pressione, è possibile ottenere la relazione tra le sue masse molari.
Esempi della legge di Avogadro nella vita di tutti i giorni
Palloncini da festa
Abbiamo mai visto un pagliaccio a una festa per bambini gonfiare i palloncini di elio per distribuirli tra i bambini. Questi palloncini sono approssimativamente alla stessa temperatura. Se due palloncini da festa sono riempiti alla stessa pressione ed entrambi hanno le stesse dimensioni, la legge di Avogadro assicura che entrambi i palloncini avranno lo stesso numero di talpe di elio.
D'altra parte, se uno dei palloncini è più grande dell'altro, avrà un volume più grande e, secondo la legge di Avogadro, avrà una maggiore quantità di particelle di elio all'interno.
Le gomme di un'auto
Indipendentemente da quale gas sono riempiti, i pneumatici sui lati opposti di un'auto sono sempre riempiti alla stessa pressione finale di circa 32 psi.
Inoltre, ci assicuriamo sempre che entrambe le gomme siano uguali, quindi avranno lo stesso volume. Pertanto, secondo il principio di Avogadro, possiamo dire che entrambe le gomme conterranno lo stesso numero di particelle gassose.
Una siringa piena d'aria
Supponiamo di avere una siringa aperta e pieno di 50 cm3 di aria. Come è aperto, l'interno della siringa e l'esterno (l'ambiente circostante) sono alla stessa temperatura e pressione.
Supponiamo ora che premiamo lo stantuffo della siringa e spostalo fino a 10 cm3. Man mano che viene scoperta la siringa, l'aria sfugge alla punta mentre lo stantuffo si muove, quindi il numero di particelle d'aria all'interno della siringa diminuisce insieme al volume.
Può servirti: volatilizzazionePoiché né la pressione né la temperatura stanno cambiando, la legge Avogadro può essere applicata per mettere in relazione il volume finale con la quantità di particelle d'aria che rimangono all'interno della siringa. Questa relazione è:

Riorganizzando questa equazione, otteniamo quella:
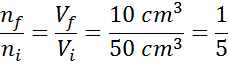
Questo risultato significa che, se riduciamo il volume all'interno della siringa al quinto, mantenendo costante p e t, allora il numero di moli o particelle presenti all'interno alla fine del processo sarà anche la quinta parte di ciò che aveva originariamente.


