Histochemistry Foundation, elaborazione, colorazione
- 4030
- 340
- Rosolino Santoro
IL Istochimica È uno strumento molto utile nello studio della morfologia di vari tessuti biologici (verdure e animali), a causa del suo principio di reazione di componenti tissutali come carboidrati, lipidi e proteine, tra gli altri.
Questo prezioso strumento consente non solo di identificare la composizione e la struttura dei tessuti e delle cellule, ma anche le varie reazioni che si verificano in queste. Allo stesso modo, possibili danni tissutali, causato dalla presenza di microrganismi o altre patologie.
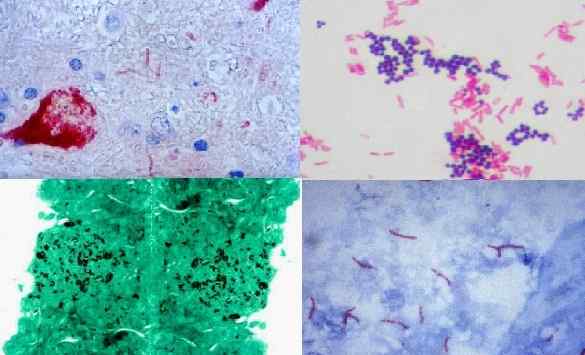
 Colorazione istochimica. Virus del Nilo, Gram Positive e Gram Negative Bacteria (Gram), Histoplasma capsulatum (Grocott), Mycobacterium tuberculosis (Ziehl Neelsen). Fonte: Pixinio.com/wikipedia.org/nefrone [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]/cdc/dr. George p. Kubica [dominio pubblico]
Colorazione istochimica. Virus del Nilo, Gram Positive e Gram Negative Bacteria (Gram), Histoplasma capsulatum (Grocott), Mycobacterium tuberculosis (Ziehl Neelsen). Fonte: Pixinio.com/wikipedia.org/nefrone [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]/cdc/dr. George p. Kubica [dominio pubblico] L'istochimica, dagli ultimi secoli, ha fornito importanti contributi, come la dimostrazione dell'esistenza della barriera delle cellule del sangue da parte di Paolo Ehrlich. Ciò è stato possibile grazie al fatto che il cervello dell'animale di sperimentazione usato da Ehrlich non ha tinto con anilina, che è un colorante di base.
Ciò ha portato all'uso di vari coloranti come metilene e blu indofenolo, al fine di tingere i diversi tipi di cellule. Questa scoperta ha dato origine alla classificazione delle cellule in acidofilo, basofilo e neutrofili, secondo la loro colorazione specifica.
Studi recenti hanno applicato questa tecnica per dimostrare la presenza di vari composti, tra cui i fenoli, nonché carboidrati e lipidi non strutturali nelle specie della specie Glaucescens LITSEA, Meglio noto come Laurel. Essendo questi, sia nel foglio che nel bosco.
Allo stesso modo COLARES et al, 2016, hanno identificato l'impianto di interesse medicinale Tarenaya Hassleriana, attraverso tecniche istochimiche. In questa specie è stata evidenziata la presenza di amido, mirosina, nonché composti fenolici e lipofili.
[TOC]
Base
L'istochimica si basa sulla colorazione di strutture cellulari o molecole presenti nei tessuti, grazie alla loro affinità con i coloranti specifici. La reazione del colore di queste strutture o molecole nel loro formato originale, viene successivamente visualizzata nel microscopio ottico o nel microscopio elettronico.
La specificità della colorazione è dovuta alla presenza di gruppi che accettano ioni presenti nelle cellule o nelle molecole di tessuto.
Infine, l'obiettivo delle reazioni istochimiche è essere in grado di evidenziare attraverso la colorazione. Dalle più grandi strutture biologiche ai più piccoli tessuti e cellule. Ciò può essere ottenuto grazie al fatto che i coloranti reagiscono chimicamente con le molecole dei tessuti, delle cellule o degli organelli.
Può servirti: cos'è la gastrazione?Accusa
La reazione istochimica potrebbe portare a passi prima della realizzazione della tecnica, come la fissazione, l'inclusione e il taglio del tessuto. Pertanto, si dovrebbe prendere in considerazione che in questi passaggi puoi danneggiare la struttura che si desidera identificare, lanciando risultati falsi negativi, anche se è presente.
Nonostante ciò, la precedente fissazione del tessuto eseguito correttamente è importante, poiché previene l'autolisi o la distruzione cellulare. Per questo.
L'inclusione del tessuto viene eseguita in modo che mantenga la sua fermezza durante il taglio e lo impedisce così di essere deformato. Infine, il taglio viene eseguito con un microtomo per lo studio dei campioni mediante microscopia ottica.
Inoltre, prima di procedere all'esecuzione della colorazione istochimica, si consiglia di incorporare controlli positivi esterni o interni in ciascun lotto di test. Così come l'uso di coloranti specifici per le strutture da studiare.
Colorazione istochimica
Dall'emergere di tecniche istochimiche ad oggi, sono state utilizzate una vasta gamma di coloranti, tra cui l'uso più frequente come: Schiff (PAS), Grocott, Ziehl-Neelsen e Gram.
Allo stesso modo, altri coloranti sono stati usati meno frequentemente come l'inchiostro cinese, la colorazione tricromica di Orceina o Masson, tra gli altri.
Acido periódic di Schiff (PAS)
Con questa colorazione puoi vedere molecole con alto contenuto di carboidrati, come: glicogeno e mucina. Tuttavia, è anche utile per l'identificazione di microrganismi come funghi e parassiti. Oltre a alcune strutture (membrana basale) nella pelle e in altri tessuti.
Il fondamento di questa colorazione è che la colorazione di Oxida i legami di carbonio presenti tra due gruppi di idrossili vicini. Questo produce il rilascio del gruppo Aldeide, e questo è rilevato dal reagente Schiff, lanciando un colore viola.
Il reagente Schiff è costituito da fucsina di base, metabisolfito di sodio e acido cloridrico, questi componenti sono responsabili della colorazione viola, quando sono presenti i gruppi di aldeide. Altrimenti viene generato un acido incolore.
Può servirti: isomerasi: cosa è, funzioni, nomenclatura, tipiL'intensità della colorazione dipenderà dalla quantità di gruppi di idrossilli presenti nei monosaccaridi. Ad esempio in funghi, membrane basali, mucinas e glicogeno il colore può passare dal rosso al viola, mentre i nuclei sono tinti blu.
Grocott
È una delle colorazioni che presenta la più grande sensibilità nell'identificazione dei funghi nei tessuti inclusi nella paraffina. Ciò consente l'identificazione delle varie strutture fungine: ife, spore, endospore, tra gli altri. Pertanto, è considerato una colorazione di routine per la diagnosi di micosi.
Soprattutto è usato nella diagnosi di micosi polmonare come pneumocistosi e aspergilosi causata da alcuni generi funghi Pneumocystis E Aspergillus, rispettivamente.
Questa soluzione contiene nitrato di acido argento e cromico, quest'ultimo è un fissativo e un colorante. La fondazione è che questo acido produce l'ossidazione degli idrossili ad aldeidi, da parte delle mucopoly presenti nelle strutture raccolte, ad esempio nella parete cellulare dei funghi.
Infine, l'argento presente nella soluzione è ossidato dalle aldeidi, causando una colorazione nera, che si chiama reazione argentafin. Puoi anche usare coloranti di contrasto come il verde chiaro e quindi le strutture fungine in nero con uno sfondo verde chiaro saranno osservate.
Ziehl-Neelsen
Questa colorazione si basa sulla presenza di resistenza alcolica acida, parzialmente o totale, in alcuni microrganismi come i generi Nocardia, Legionella e Mycobacterium.
Si consiglia l'uso di questa colorazione, poiché la parete cellulare dei microrganismi precedentemente citati, contiene lipidi complessi che ostacolano la penetrazione della colorazione. Specialmente nei campioni di tratto respiratorio.
I coloranti forti come Fenicada Fuchsin (colorante di base) sono usati in esso e il calore viene applicato in modo che il microrganismo possa trattenere il colorante e non scolorire con acidi e alcoli. Infine, viene applicata una soluzione blu di metilene per colorare le strutture che sono state scolorite.
La presenza di resistenza all'acido alcol è osservata nelle strutture rosse, mentre le strutture che non resistono allo scolorimento sono tinte blu.
Grammo e inchiostro cinese
Gram è una colorazione molto utile nella diagnosi di infezioni batteriche e fungine, tra le altre. Questa colorazione consente di distinguere tra i microrganismi gram positivi del grammo negativo, evidenziando chiaramente le differenze che esistono nella composizione della parete cellulare.
Può servirti: lipidi saponificabili: caratteristiche, struttura, funzioni, esempiMentre l'inchiostro cinese è una colorazione che viene utilizzata per contrastare le strutture contenenti polisaccaridi (capsula). Questo perché un anello si forma nell'ambiente, essendo possibile nel Cryptococcus neoformans.
Orceina
Con questa colorazione, sono colorate fibre elastiche e cromosomi di varie cellule, consentendo la valutazione del processo di maturazione di quest'ultimo. Per questo motivo, è stato molto utile negli studi citogenetici.
Questo si basa sulla raccolta del colorante da parte del carico negativo di molecole come il DNA, presente nei centri dell'ampia varietà di cellule. Quindi questi sono tinti blu a viola scuro.
Il tricromico di Masson
Questa colorazione viene utilizzata nell'identificazione di alcuni microrganismi o materiali che contengono pigmenti mellatici. Questo è il caso della micosi, causata da funghi demaziaci, ugohifomicosi e in grano nero eumicetoma.
Considerazioni finali
Negli ultimi anni ci sono stati molti progressi nella creazione di nuove tecniche diagnostiche, in cui è coinvolta l'istochimica ma legata ad altre basi o principi. Queste tecniche perseguono uno scopo diverso, come nel caso dell'immunoistochimica o dell'enzimoistochimica.
Riferimenti
- Acuña U, Elguero J. Istochimica. UN. Chimica. 2012; 108 (2): 114-118. Disponibile su: sono.IQM.CSIC.È
- Mestanza r. Frequenza della colorazione istochimica di PAS, Grocott e Ziehl-Neelsen utilizzati per l'identificazione di microrganismi, eseguiti nel servizio patologico di anatomia dell'Eugenio Espejo Speciali Hospital nel 2015. [Tesi di laurea]. Central University of Ecuador, Quito; 2016. Disponibile su: dspace.Uce.Edu
- Tapia-Torres N, de la Paz-Pérez-Olvera C, Román-Guerrero A, Quintanar-Isaías A, García-Márquez E, Cruz-Sosa F. Istochimica, contenuto di fenoli totali e attività antiossidante di foglie e legno Glaucescens LITSEA Kunth (Laureaceae). Legno e foreste. 2014; 20 (3): 125-137. Disponibile su: Redalyc.org
- Colari, MN, Martínez-Alonso, S, Arambarri, AM. Anatomia e istochimica di Tarenaya Hassleriana (Cleomaceae), una specie di interesse medicinale. Bollettino latinoamericano e caraibico di piante medicinali e aromatiche 2016; 15 (3): 182-191. Disponibile su: Redalyc.org
- Bonifaz a. Micologia medica di base. 4a edizione. Messico: McGraw-Hill Inter-American Editors, S.A. di c.V. 2012.
- Silva Diego Filipe Bezerra, Santos Hellen Bandeira de Pontes, León Jorge Esquiche, Gomes Dalian. Analisi clinica patologica e immunoistochimica del carcinoma a cellule squamose a cellule del fuso. Einstein (San Paolo) 2019; 17 (1): ERC4610. Disponibile da: scielo.Br
- « Caratteristiche di colorazione ematossilina-eosina, usi, tecniche
- Struttura di idrossido di rame (ii), proprietà, nomenclatura, usi »

