Struttura di idrossido di calcio (Ca (OH) 2), proprietà, ottenimento, usi

- 2395
- 429
- Silvano Montanari
Lui idrossido di calcio È un composto inorganico la cui formula chimica è Ca (OH)2. È una polvere bianca che è stata utilizzata per migliaia di anni, in tutto il quale ha vinto diversi nomi o soprannomi tradizionali; Tra questi, possiamo menzionare il noioso, morto, chimico, idratato o fine.
In natura è disponibile in un piccolo minerale abbondante chiamato Portlantita, dello stesso colore. Per questo motivo la ca (oh)2 Non è ottenuto direttamente da questo minerale, ma da un trattamento termico, seguito dall'idratazione, di calcare. Questo è ottenuto da Lime, CAO, che successivamente si spegne o idrata per produrre CA (OH)2.
 Un campione solido di idrossido di calcio. Fonte: ChemicalIrrest [dominio pubblico]
Un campione solido di idrossido di calcio. Fonte: ChemicalIrrest [dominio pubblico] Il ca (oh)2 È una base relativamente debole in acqua, poiché può appena dissolvere in acqua calda; Ma la sua solubilità aumenta nell'acqua fredda, perché la sua idratazione è esotermica. Tuttavia, la sua basicità continua ad essere un motivo per stare attento durante la sua manipolazione, in quanto può causare ustioni in qualsiasi parte del corpo.
È stato usato come regolatore di pH per materiali o alimenti diversi, oltre ad essere una buona fonte di calcio in materia di massa. Ha applicazioni nell'industria cartacea, nella disinfezione delle acque reflue, nella depilazione di prodotti, in generi alimentari fatti di farina di mais.
Tuttavia, il suo uso più importante è stato come materiale da costruzione, poiché la calce è idratata quando si mescola con gli altri ingredienti dell'intonaco o del mortaio. In queste miscele indurite, CA (OH)2 Assorbire l'anidride carbonica dell'aria per consolidare i cristalli di sabbia insieme al carbonato di calcio formato.
Attualmente la ricerca è ancora condotta con l'obiettivo di sviluppare materiali da costruzione migliori che hanno CA (OH)2 direttamente nella sua composizione come nanoparticelle.
[TOC]
Struttura
Cristallo e i suoi ioni
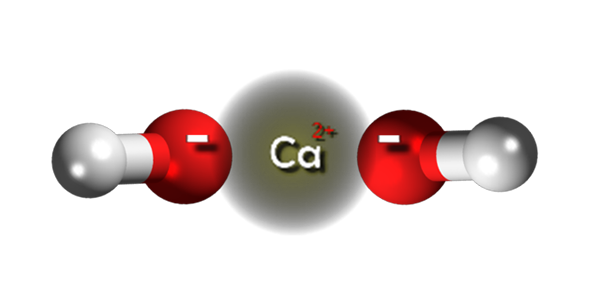 Ioni idrossido di calcio. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Ioni idrossido di calcio. Fonte: Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Nell'immagine superiore abbiamo gli ioni che integrano l'idrossido di calcio. La sua stessa formula CA (OH)2 sottolinea che per ogni cation ca2+ Ci sono due anioni oh- che interagiscono con lui per attrazione elettrostatica. Il risultato è che entrambi gli ioni finiscono per stabilire un cristallo della struttura esagonale.
In tali cristalli esagonali di Ca (OH)2 Gli ioni sono molto vicini l'uno all'altro, il che dà l'aspetto di essere una struttura polimerica; Sebbene non vi sia formalmente un legame covalente CA-O comunque data la notevole differenza di elettronegatività tra i due elementi.
 Struttura di idrossido di calcio
Struttura di idrossido di calcio La struttura genera Octaedros Cao6, Cioè, il CA2+ Interagisci con sei oh- (AC2+-OH-).
Può servirti: idrossido di litio (Lioh)Una serie di questi ottaedri costituisce uno strato di vetro, che può interagire con un altro con ponti idrogeno che li mantengono intermolecolarmente coesivi; Tuttavia, questa interazione svanisce a una temperatura di 580 ºC, quando il Ca (OH) è disidratato2 a Cao.
Dal lato delle alte pressioni, non ci sono molte informazioni al riguardo, sebbene gli studi hanno verificato che a una pressione di 6 GPa il vetro esagonale subisce una transizione dall'esagonale alla fase monoclinica; E con questo, la deformazione dell'Octaedros Cao6 e i suoi strati.
Morfologia
I cristalli Ca (OH)2 Sono esagonali, ma questo non è un impedimento per loro adottare alcuna morfologia. Alcune di queste strutture (fili, fiocchi o rocce) sono più porose di altre, robuste o piatte, il che influenza direttamente le loro applicazioni finali.
Pertanto, non è lo stesso usare cristalli del minerale di Portland, piuttosto che sintetizzarli in modo che siano costituiti da nanoparticelle in cui vengono seguiti alcuni parametri rigorosi; come il grado di idratazione, la concentrazione del CAO utilizzato e il tempo ha permesso di coltivare il vetro.
Proprietà
Aspetto fisico
Solido bianco, toilette e sapore amaro solido.
Massa molare
74.093 g/mol
Punto di fusione
580 ºC. A questa temperatura si rompe rilasciando acqua, quindi non arriva mai per vaporizzare:
Ca (Oh)2 => Cao + H2O
Densità
2.211 g/cm3
ph
Una soluzione acquosa acquosa ha un pH da 12,4 a 25 ºC.
Solubilità dell'acqua
La solubilità di Ca (OH)2 In acqua diminuisce con un aumento della temperatura. Ad esempio, a 0 ºC la sua solubilità è 1,89 g/L; Mentre a 20 ºC e 100 ºC, questi sono rispettivamente 1,73 g/L e 0,66 g/L.
Ciò indica un fatto termodinamico: idratazione CA (OH)2 È esotermico, quindi obbedire al principio di Le Catetier l'equazione sarebbe:
Ca (Oh)2 AC2+ + 2oh- + Q
Dov'è il calore rilasciato. Più calda l'acqua, l'equilibrio tenderà più a sinistra; cioè, il ca (oh) si dissolverà di meno2. È per questo motivo che nell'acqua fredda si dissolve molto più che nell'acqua bollente.
D'altra parte, questa solubilità aumenta se il pH diventa acido, a causa della neutralizzazione degli ioni OH- e allo spostamento del saldo precedente a destra. Durante questo processo viene rilasciato ancora più calore che in acqua neutra. Oltre alle soluzioni acquose acide, CA (OH)2 È anche solubile in glicerolo.
K$
5,5 · 10-6. Questo valore è considerato piccolo e concorda con la bassa solubilità di CA (OH)2 Nell'acqua (lo stesso equilibrio sopra).
Può servirti: metalliIndice di rifrazione
1.574
Stabilità
Il ca (oh)2 Rimane stabile fintanto che non è esposto a CO2 dell'aria, poiché lo assorbe e forma carbonato di calcio, caco3. Pertanto, inizia ad essere impurificato in una solida miscela di cristalli Ca (OH)2-Ladro3, Dove ci sono co -anioni32- competere con oh- Per interagire con CA2+:
Ca (Oh)2 + Co2 => Caco3 + H2O
In effetti, questo è il motivo per cui le soluzioni concentrate di Ca (OH)2 Vengono i letti, quando appare una sospensione di particelle di caco3.
Ottenimento
Il ca (oh)2 Si ottiene commercialmente reagendo la calce, CAO, con un eccesso di due o tre volte di acqua:
Cao + H2O => ca (oh)2
Tuttavia, la carbonizzazione di CA (OH) può verificarsi nel processo2, Proprio come spiegato sopra.
Altri metodi per ottenerlo consistono nell'uso di sali di calcio solubili, come il clic2 o CA (no3)2, e basali con Naoh, in modo che il ca (oh) si precipiti2. Controllo dei parametri come volumi di acqua, temperatura, pH, solvente, grado di carbonizzazione, tempo di maturazione, ecc., Le nanoparticelle con morfologie diverse possono essere sintetizzate.
Può anche essere preparato selezionando materie prime naturali e rinnovabili, o lo spreco di un'industria, che sono ricchi di calcio, che quando le loro ceneri sono riscaldate e elaborate consistono in calce; E da qui, di nuovo, CA (OH) può essere preparato2 Idratando queste ceneri senza la necessità di sprecare il calcare, Caco3.
Ad esempio, il Bagazo del Agave è stato utilizzato per questo scopo, assegnando un valore aggiunto allo spreco delle industrie della tequila.
Applicazioni
Trattamento alimentare
 I sottaceti vengono prima immersi in idrossido di calcio per essere più croccanti. Fonte: Pixabay.
I sottaceti vengono prima immersi in idrossido di calcio per essere più croccanti. Fonte: Pixabay. L'idrossido di calcio è presente in molti alimenti in alcune delle sue fasi di preparazione. Ad esempio, in una soluzione acquosa, i sottaceti sono immersi, come i cetrioli, per trasformarli più croccanti quando li imballano in aceto. Questo perché le proteine della loro superficie assorbono il calcio nel mezzo.
Allo stesso modo si verifica con i cereali prima di trasformarli in farina, perché aiuta a rilasciare la vitamina B3 (Niacina) e facilita la sua macinatura. Il calcio che fornisce viene anche utilizzato per aggiungere valore nutrizionale a determinati succhi.
Il ca (oh)2 Puoi anche sostituire il lievito in alcune ricette di pane e chiarire le soluzioni di zucchero da canna da zucchero e barbabietole.
Disinfettante delle acque reflue
Azione chiarificativa di Ca (OH)2 È perché funge da agente flocculante; Cioè, la dimensione delle particelle sospese aumenta per formare flocculus, che successivamente sedimenti o possono filtrare.
Può servirti: Pauling ScaleQuesta proprietà è stata usata per disinfettare le acque reflue, destabilizzando i suoi spiacevoli colloidi in vista (e odore) degli spettatori.
Industria cartacea
Il ca (oh)2 Viene utilizzato nel processo Kraft per rigenerare il NaOH utilizzato per trattare il legno.
Assorbente del gas
Il ca (oh)2 È usato per eliminare CO2 di spazi chiusi o in ambienti in cui la loro presenza è controproducente.
Cura personale
Nelle formulazioni per le creme depilatorie il CA (OH)2 È tacitamente, perché la sua basicità aiuta nell'indebolimento della cheratina dei peli, e quindi è più facile rimuoverli.
Costruzione
 L'idrossido di calcio fa parte delle strutture di vecchi lavori di costruzione come le piramidi dell'Egitto. Fonte: Pexels.
L'idrossido di calcio fa parte delle strutture di vecchi lavori di costruzione come le piramidi dell'Egitto. Fonte: Pexels. Il ca (oh)2 È presente da tempo immemorabile che integra le masse di intonaco e mortaio utilizzate nella costruzione di opere architettoniche egiziane come le piramidi; Anche edifici, mausolei, pareti, scale, pavimenti, supporti e persino per ricostruire il cemento dentale.
La sua azione fortificante è dovuta al fatto che "respirando" il co2, I cristalli risultanti da Caco3 Le sabbie e altri componenti di tali miscele finiscono in modo migliore.
Rischi ed effetti collaterali
Il ca (oh)2 Non è un solido fortemente basilare rispetto ad altri idrossidi, sebbene più del MG (OH)2. Anche così, nonostante non sia reattivo o infiammabile, la sua basicità è ancora abbastanza aggressiva da causare lievi ustioni.
Pertanto, deve essere manipolato con rispetto, perché è in grado di irritare gli occhi, la lingua e i polmoni, oltre a innescare altri mali come: perdita della vista, grave alcalinizzazione di sangue, eruzioni cutanee, vomito e dolore alla gola.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2019). Calcio idrossido. Recuperato da: in.Wikipedia.org
- Chávez Guerrero et al. (2016). Sintesi e caratterizzazione dell'idrossido di calcio ottenuto dalla bagassa di agave e ricerca della sua attività antibatterica. Recuperato da: scielo.org.MX
- Riko Iizuka, Takehiko Yagi, Kazuki Komatsu, Hirotada Goou, Taku Tsuchiya, Keiji Kusaba, Hiroyuki Kagi. (2013). Struttura cristallina della fase ad alta pressione di idrossido di calcio, portlandite: polvere in situ e studio di diffrazione dei raggi X a cristallo singolo. Mineralogista americano; 98 (8-9): 1421-1428. Doi: doi.org/10.2138/am.2013.4386
- Hans Lohninger. (5 giugno 2019). Calcio idrossido. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Aniruddha s. et al. (2015). Sintesi di idrossido di nano calcio nel mezzo di afflizione. L'American Ceramic Society. doi.org/10.1111/Jace.14023
- Carly Vandergrindt. (12 aprile 2018). Come viene utilizzato l'idrossido di calcio negli alimenti ed è sicuro? Recuperato da: Healthline.com
- Brian Clegg. (26 maggio 2015). Calcio idrossido. Recuperato da: Chemistryworld.com
- « Caratteristiche ed esempi di fenomeni chimici
- Caratteristiche del mesohyppus, specie, riproduzione, nutrizione »

