Proprietà di idrocarburi alifatici, nomenclatura, reazioni, tipi

- 1875
- 354
- Enzo De Angelis
IL Idrocarburi alifatici Sono tutti coloro che mancano di aromaticità, non in senso olfattivo, ma per quanto riguarda la stabilità chimica. Classificare gli idrocarburi in questo modo è oggi troppo ambiguo e impreciso, poiché non discrimina tra vari tipi di idrocarburi che non sono aromatici.
Pertanto, abbiamo idrocarburi alifatici e idrocarburi aromatici. Questi ultimi sono riconosciuti dalla loro unità di base: l'anello Benncénico. Gli altri, d'altra parte, possono adottare qualsiasi struttura molecolare: lineare, ramificato, ciclico, insaturo, policicico; Finché non hanno sistemi coniugati come il benzene.
 Il combustibile fluido degli accendini è costituito da una miscela di idrocarburi alifatici. Fonte: Pixnio.
Il combustibile fluido degli accendini è costituito da una miscela di idrocarburi alifatici. Fonte: Pixnio. Il termine "alifatico" è nato dalla parola greca "Aleiphar", che significa grasso, usato anche per fare riferimento agli oli. Pertanto, nel diciannovesimo secolo questa classificazione fu assegnata agli idrocarburi ottenuti dagli estratti oleosi; Mentre gli idrocarburi aromatici sono stati estratti da resine dell'albero e profumate.
Tuttavia, come base della chimica organica consolidata, è stato scoperto che esisteva una proprietà chimica che differenziava gli idrocarburi, ancora più importanti delle loro fonti naturali: aromaticità (e non fragranza).
In questo modo, gli idrocarburi alifatici hanno cessato di essere solo quelli ottenuti dai grassi, per essere tutti quelli che non hanno aromaticità. All'interno di questa famiglia abbiamo alcheni e alchini, indipendentemente dal fatto che siano lineari o ciclici. Ecco perché "alifatico" è considerato inaccurato; Sebbene sia utile per affrontare alcuni aspetti generali.
Ad esempio, quando si dice "estremi" o "catene" regioni alifatiche e molecolari sono allude a dove sono assenti gli anelli aromatici. Di tutti gli idrocarburi alifatici, il più semplice per definizione è il metano, Cho4; Mentre il benzene è il più semplice degli idrocarburi aromatici.
[TOC]
Proprietà degli idrocarburi alifatici
Le proprietà degli idrocarburi alifatici oscillano in diversi gradi a seconda di quali sono considerate. Ci sono masse basse e alte molecolari, nonché lineari, ramificate, cicliche o policicliche, anche quelle di straordinarie strutture tridimensionali; Come con il cubano, sotto forma di un cubo.
Tuttavia, ci sono alcune generalità che possono essere menzionate. La maggior parte degli idrocarburi alifatici sono gas o liquidi idrofobici e apolari, con alcuni più apolari di altri, poiché anche quelli nelle cui catene di carbonio hanno atomi di alogeno, ossigeno, azoto o zolfo sono inclusi nell'elenco.
Può servirti: boro: storia, proprietà, struttura, usiSono anche composti infiammabili, poiché sono suscettibili all'ossidazione dell'aria prima di una fonte di calore minima. Questa caratteristica diventa più pericolosa se aggiungiamo la sua elevata volatilità, a causa delle deboli interazioni dispersive che mantengono le molecole alifatiche coesive.
Ad esempio, lo vediamo nel butano, un gas che può essere liquefatto con relativa facilità e propano. Entrambi sono molto volatili e infiammabili, quindi sono componenti attivi di gas da cucina o tasca.
Naturalmente, tale volatilità tende a diminuire poiché la massa molecolare e l'idrocarburo causano liquidi sempre più viscosi.
Nomenclatura
La nomenclatura degli idrocarburi differisce anche più delle sue proprietà. Se sono alko o alcine, vengono seguiti gli stessi standard stipulati dall'IUPAC: selezionare la catena più lunga, assegnando gli indicatori più bassi all'estremità più sostituita o agli eteroatomi o più gruppi reattivi.
In questo modo sai in quale carbonio si trovano ogni sostituente, o persino insaturazione (collegamenti doppi o tripli). Nel caso di idrocarburi ciclici, il nome è preceduto dai sostituenti elencati in ordine alfabetico, seguito dalla parola "ciclo", contando i numeri di carbonio che lo integrano.
Ad esempio, considera i seguenti due cicloesani:
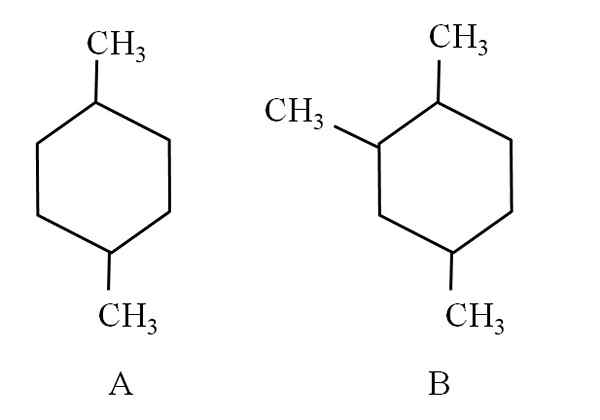 Due cicloesani, che sono classificati come idrocarburi alifatici. Fonte: Gabriel Bolívar.
Due cicloesani, che sono classificati come idrocarburi alifatici. Fonte: Gabriel Bolívar. Cyclohexan A, è chiamato 1.4-dimetilciclohexan. Se l'anello fosse cinque carboni, sarebbe 1,4-dimetilciclopentano. Nel frattempo, il cicloesano B è chiamato 1,2,4-trimetilcicloesano e non 1,4,6-ciclohexan, in quanto cerca di utilizzare gli indicatori più bassi.
Ora, la nomenclatura può diventare molto complicata per le strutture operabotiche idrocarburi. Per loro ci sono regole più specifiche, che devono essere spiegate separatamente e attentamente; Come per gli obiettivi, terpeni, politiche e composti policiclici.
Reazioni
Combustione
Fortunatamente, le reazioni sono meno varie per questi idrocarburi. Uno di questi era già menzionato: si combusta facilmente, producendo anidride carbonica e acqua, oltre ad altri ossidi o gas a seconda della presenza di eteroatomi (Cl, N, P, O, ecc.). Tuttavia, il CO2 e h2O sono i principali prodotti di combustione.
Aggiunta
Se hanno insaturazione possono subire reazioni di addizione; Cioè, incorporano piccole molecole nel loro scheletro come sostituenti seguendo un meccanismo specifico. Tra queste molecole abbiamo quello di acqua, idrogeno e alogeni (f2, Cl2, Br2 e io2).
Alogenazione
D'altra parte, idrocarburi alifatici sotto l'incidenza della radiazione ultravioletta (HV) e il calore può rompere i collegamenti C-H per cambiarli con collegamenti C-X (C-F, C-CL, ecc.). Questa è la reazione di alogenazione, che si osserva in alcani a catena molto corta, come metano o pentan.
Può servirti: nitriti: proprietà, struttura, nomenclatura, formazioneCraqueo
Un'altra reazione che gli idrocarburi alifatici possono soffrire, in particolare gli alcani a catena lunga, è il cracking termico. È costituito dalla fornitura di calore intenso in modo che l'energia termica rompa i legami C-C, e quindi le piccole molecole, più citate nel mercato del carburante, da grandi molecole si formano.
Le quattro reazioni sopra sono le principali che possono subire un idrocarburo alifatico, la combustione è la più importante di tutte, in quanto non discrimina alcun composto; Tutto brucerà in presenza di ossigeno, ma non tutti aggiungeranno molecole o si romperanno in piccole molecole.
Ragazzi
Il gruppo di idrocarburi alifatici ha infiniti composti, che a loro volta sono classificati più specifici, indicando il grado di insaturazione, nonché il tipo di struttura che hanno.
Secondo quanto sono insaturi, abbiamo gli alcani (saturi), gli alcheni e gli alchini (insaturi).
Gli alcani sono caratterizzati da semplici collegamenti C-C, mentre in alcheni e alcine osserviamo i collegamenti C = C e C /c, rispettivamente. Un modo molto generale per visualizzarli è pensare agli scheletri di carbonio degli alcani come zigzagen e catene piegate, essendo "quadrati" per alcheni e "linee rette" per le alcine.
Questo perché i legami doppi e tripli hanno energia e restrizioni steneriche nelle loro rotazioni, "indurimento" le loro strutture.
Alkitos e alchine possono essere ramificati, ciclici o policiclici. Questo è il motivo per cui cicloalcani, cicloalquenos, cicloalquinos e composti come la decalina (struttura in bicicletta), l'Adamantano (simile a un cappuccio da baseball), l'eptalene, Gonano, tra gli altri, sono considerati idrocarburi alifatici.
Dagli alcheni sorgono altri tipi di idrocarburi, come gli obiettivi (con due doppi legami), polienosi (con molti doppi legami alternativi) e terpeni (composti derivati dall'isoprene, un danno).
Applicazioni
Ancora una volta, gli usi per questi idrocarburi possono variare a seconda di chi è considerato. Tuttavia, nelle sezioni di proprietà e reazioni è stato chiarito che tutta la combustione, non solo per rilasciare molecole di gas, ma anche di luce e calore. Pertanto, sono serbatoi di energia, utili per fungere da combustibili o fonti di calore.
Ecco perché sono usati come parte della composizione della benzina, per il gas naturale, negli accendini Bunsen e in generale per essere in grado di originare il fuoco.
Può servirti: regola degli ottettiUno degli esempi più notevoli è quello dell'acetilene, HC≡ch, la cui combustione consente di eccitare gli ioni metallici di un campione nella spettrometria di assorbimento atomico eseguita su test analitici. Allo stesso modo, il fuoco risultante può essere utilizzato per le saldature.
Gli idrocarburi alifatici liquidi, come le paraffinici, sono spesso usati come solventi di estrazione grasso. Inoltre, la sua azione del solvente può essere utilizzata per rimuovere punti, smalti, dipinti o semplicemente per preparare soluzioni di un composto organico specifico.
La massa molecolare più grande, già viscosa o solida, è destinata all'elaborazione di resine, polimeri o medicinali.
Per quanto riguarda il termine "alifatico", di solito viene utilizzato per riferirsi a quelle regioni, in una macromolecola, che mancano di aromaticità. Ad esempio, gli asfaltensi sono descritti superficialmente come un nucleo aromatico con catene alifatiche.
Esempi
Inizialmente si diceva che il metano è il più semplice degli idrocarburi alifatici. Sono seguiti da propano, Cho3Cap2Cap3, Butano, ch3Cap2Cap2Cap3, Pentano, ch3Cap2Cap2Cap2Cap3, ottano, nonno, decano e così via, con alcani sempre più lunghi.
Lo stesso vale per l'etilene, Cho2= Ch2, Propeno, cap3Ch = ch2, Buteno, ch3Cap2Ch = ch3, E per il resto delle alcine. Se ci sono due doppi legami, sono oley e se ce ne sono più di due, poliena. Allo stesso modo, potrebbero esserci collegamenti doppi e tripli nello stesso scheletro, aumentando la complessità strutturale.
Tra i cicloalcani possiamo menzionare il ciclopropano, il ciclobutano, il ciclopentano, il cicloesano, il cicloheptano, il ciclooctano, nonché il cicloesen e il cicloesina. Da tutti questi idrocarburi, si ottengono derivati ramificati, moltiplicando ulteriormente gli esempi disponibili (come 1.4-dimetilciclohexano).
Dei terpeni più rappresentativi abbiamo limonene, mentolo, pinene, vitamina A, esca, ecc. Il polietilene è un polimero saturo con unità -CH2-Cap2-, Quindi è anche un esempio di questi idrocarburi. Altri esempi sono già stati citati nelle sezioni precedenti.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. Ammine. (10a edizione.). Wiley Plus.
- Helmestine, Anne Marie, PH.D. (22 agosto 2019). Definizione di idrocarburi alifatici. Recuperato da: Thoughtco.com
- Wikipedia. (2019). Composto alifatico. Recuperato da: in.Wikipedia.org
- Chimica librettexts. (20 agosto 2019). Idrocarburi alifatici. Recuperato da: Chem.Librettexts.org
- Elizabeth Wyman. (2019). Idrocarburi alifatici: definizione e proprietà. Studio. Recuperato da: studio.com
- « La dimensione sociale è umana, educazione, conoscenza, diritto, salute
- 100 curiosi dati sugli animali »

