Caratteristiche di emoolisina, tipi, meccanismi d'azione
- 3730
- 213
- Zelida Gatti
IL Emoolisina È una piccola proteina che causa i pori nella membrana cellulare degli eritrociti e alcune altre cellule del sangue dei mammiferi. È generalmente sintetizzato ed escreto da batteri patogeni.
Questa proteina è una delle tossine microbiche più comuni e quella che è stata meglio studiata. A volte può causare anemia emolitica, poiché la quantità di canali attraverso i quali esce l'interno cellulare può persino causare la lisi cellulare.
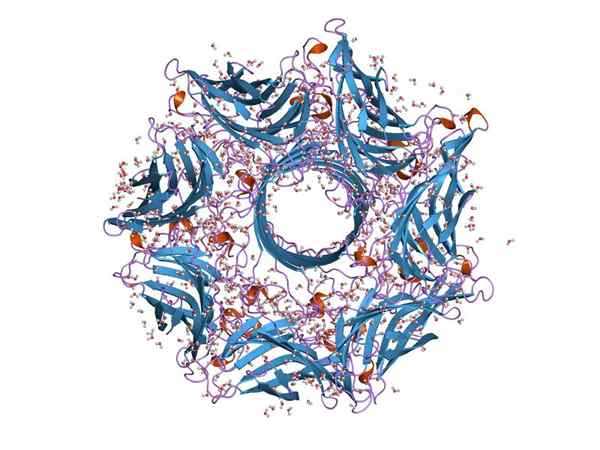
 Struttura molecolare di una emoolisina (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Domata pubblica] tramite Wikimedia Commons)
Struttura molecolare di una emoolisina (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Domata pubblica] tramite Wikimedia Commons) Generalmente, l'emoolisina è una tossina tipica della specie di Streptococco del tratto intestinale. La sua funzione consente ai batteri di rompere la barriera epiteliale del tratto intestinale e quindi muoversi attraverso il flusso sanguigno per colonizzare altri tessuti.
Il modo più comune in cui si trova l'emoolisina in natura è nella sua forma α-emolisina. Questa proteina è uno dei più importanti fattori di virulenza della maggior parte dei ceppi di Escherichia coli e alcuni Clostrides.
La maggior parte delle infezioni del tratto urinario sono causate da ceppi di Escherichia coli che producono α-emolisina con caratteristiche emolitiche.
La produzione di emoolisina e batteriocina è stata correlata a ceppi batterici con un meccanismo di competenza contro altre specie e la produzione di entrambe le tossine sembra dipendere dagli stessi determinanti genetici nel genoma dei batteri.
[TOC]
Caratteristiche
L'emoolisina è costituita da sette subunità e dal gene che codifica ha sette promotori. Queste sette subunità sono inserite nella membrana plasmatica dei cellule bianche e, quando insieme, formano un canale ionico in cui i metaboliti dell'interno cellulare sfuggono.
L'emoolisina è extracellulare di citotossina dipendente dal calcio (Ca+2) che agisce sulla membrana plasmatica delle cellule torrent nel sangue. I pori che creano nella membrana sono anche idrofili e causano l'ingresso di acqua all'interno, il che può causare lisi.
Può servirti: non autore: trasporto attraverso membrane, caratteristicheLe emoolisine sono prodotti proteici tipici dei batteri di tipo Gram-negativo e tutti condividono due caratteristiche:
1- La presenza di un peptide molto piccolo (non apéptide) formata da glicina ripetuta e acido aspartico. I non apapéptidi di emoolisina si trovano vicino alla porzione C-terminale della struttura proteica primaria.
2- Tutte le emoolisine sono secrete dal batterio sul mezzo extracellulare attraverso un trasportatore di tipo ABC (dalla cassetta inglese legante l'ATP).
Le emoolisine vengono generalmente rilevate nei ceppi batterici attraverso la crescita nel mezzo dell'agar nel sangue. Nel test, si osserva un alone emolitico, prodotto della rottura dei globuli rossi vicino alle colonie di batteri.
Ragazzi
Esistono diversi tipi di emoolisine, questi sono classificati con una lettera greca all'inizio del loro nome. Le più studiate e comuni sono le emoolisine α, β e γ, tutte prodotte dal ceppo Staphylococcus aureus.
I tipi di emoolisina sono classificati in base alla gamma di cellule che attaccano e secondo la loro struttura proteica primaria.
α-emolisina
Questa proteina è tipica dei ceppi di Staphylococcus aureus E Escherichia coli; attacchi neutrofili, globuli rossi, linfociti, macrofagi, fibroblasti adulti ed embrionali. Interagisci con le teste polari dei lipidi di membrana plasmatica di queste cellule fino a interiorizzare una coda idrofobica di circa 5 ӑ all'interno della membrana.
β-emolisina
Prodotto da Staphylococcus aureus In una proporzione minore rispetto all'α-emolisina, la β-emolisina attacca principalmente gli eritrociti ed è interno nella membrana esclusivamente attraverso domini ricchi in sfingomyeline della membrana cellulare.
γ-emolisina
È stato anche osservato in Staphylococcus aureus. È stato classificato come una proteina emolitica e la leucotossina allo stesso tempo, poiché colpisce le cellule polimorfonucleate di esseri umani, monociti, macrofagi e raramente, persino ai globuli rossi.
Questo tipo di γ-emolisina è uno dei meno caratterizzati, quindi gran parte del suo meccanismo d'azione è stato sconosciuto e questo non è stato studiato In vivo.
Può servirti: osteoblasti: formazione, caratteristiche, funzioni, patologieMeccanismi d'azione
Il meccanismo d'azione che è stato chiarito relativamente chiaro è quello dell'α-emolisina. Tuttavia, poiché tutte sono proteine emolitiche, si pensa che la maggior parte dei processi sia comune per tutte le emolisine.
Gli scienziati suggeriscono che per i batteri separano l'emoolisina nell'ambiente devono essere in un microambiente poro di nutrienti, quindi questo sarebbe un meccanismo che innesca la cellula per distruggere i globuli bianchi e ottenere i loro nutrienti.
Il meccanismo è stato descritto in tre fasi: l'unione per la membrana cellulare, l'inserimento e l'oligomerizzazione.
Union della membrana
È stato scoperto che le emoolisine possono unirsi alle integrine dei neutrofili e negli eritrociti è stato osservato che queste proteine si legano a componenti glicosilati come glicoproteine, ganliani e glishorine della membrana cellulare.
Alcuni autori suggeriscono che la presenza di recettori nella membrana non è essenziale per l'Unione delle emolisine. In ogni caso, il meccanismo di riconquistare la proteina cellulare non è ancora noto proprio.
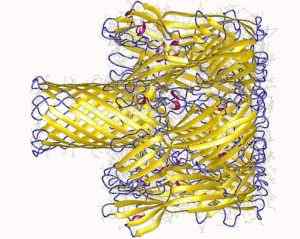 Poro transmembrano formato dalla proteina emoolisina dello stafilococco (fonte: autori di deposizione: Song, L., Hobaugh, m., Shustak, c., Cheley, s., Bayley, h., Gouaux, J.E.; Autore di visualizzazione: Utente: Astrojan [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] via Wikimedia Commons)
Poro transmembrano formato dalla proteina emoolisina dello stafilococco (fonte: autori di deposizione: Song, L., Hobaugh, m., Shustak, c., Cheley, s., Bayley, h., Gouaux, J.E.; Autore di visualizzazione: Utente: Astrojan [CC di 3.0 (https: // creativeCommons.Org/licenze/di/3.0)] via Wikimedia Commons) L'interazione con la membrana si verifica in due passaggi:
- Unione iniziale (reversibile): quando l'emoolisina si lega ai domini di giunzione del calcio della membrana. Questo passaggio si verifica in superficie ed è molto suscettibile alle scariche elettrostatiche.
- Unione irreversibile: prenota i domini di aminoacidi con i componenti lipidici dello strato esterno della membrana plasmatica dei cellule bianche, al fine di formare sindacati fisici tra i composti idrofobici della membrana.
Può servirti: parete cellulareInserimento di tossina nella membrana
Α-emolisina inserisce i rifiuti 177 e 411 nel primo monostrato lipidico. Nel mezzo extracellulare, l'emoolisina è associata a ioni di calcio, che inducono una disposizione strutturale in questo e contribuiscono alla sua attivazione.
Questo inserimento consolida l'unione irreversibile alla membrana cellulare. Una volta che si è verificata la disposizione, l'emoolisina diventa una proteina integrale poiché, sperimentalmente, è stato dimostrato che l'unico modo per estrarla dalla membrana è attraverso l'uso di detergenti come Triton X-100.
Oligomerizzazione
Quando tutta l'emoolisina è stata inserita nella membrana plasmatica delle cellule bianche.
È stato osservato che il processo di oligomerizzazione è favorito da microdomini o balsas lipidici della membrana cellulare. Queste regioni potrebbero non favorire l'unione della proteina, ma favoriscono l'oligomerizzazione una volta inserite.
Più emoolisine si legano alla membrana, maggiore sarà la quantità di pori. Inoltre, le emoolisine possono oligomerizzare tra loro (adiacenti) e formare canali molto più grandi.
Riferimenti
- Bakás, l., OSTolaza, h., Vaz, w. L., & Goñi, f. M. (millenovecentonovantasei). Adsorbimento reversibile e inserimento non reversibile di Escherichia coli Alpha-Emolisina in doppi strati lipidici. Biofysical Journal, 71 (4), 1869-1876.
- Dalla Serra, M., Coraiola, m., Viero, g., Comai, m., Potrich, c., Ferreras, m.,… E prévot, G. (2005). Staphylococcus aureus bicomponente γ-emolisina, HLGA, HLGB e HLGC, possono miscelare per contare tutti i componenti. Journal of Chemical Information and Modeling, 45 (6), 1539-1545.
- Gow, j. A., & Robinson, J. (1969). Proprietà della β-emolisina stafilococcica purificata. Journal of Bacteriology, 97 (3), 1026-1032.
- Ike, e., Hashimoto, h., & Clewell, D. B. (1984). Emolisina di Streptococcus faecalis Subpecie Zymogenes Contribuisci alla virulenza nei topi. Infezione e immunità, 45 (2), 528-530.
- Remington, J. S., Klein, J. O., Wilson, c. B., Nizet, v., & Maldonado, e. A. (Eds.). (1976). Deserti infettivi del feto e del neonato (Vol. 4). Filadelfia: Saunders.
- Todd, e. W. (1932). Emolisina streptococcica antigenica. Journal of Experimental Medicine, 55 (2), 267-280.
- « Origine Pietrain, caratteristiche, cibo, riproduzione
- Caratteristiche delle valvole connive, istologia, funzioni »

