Gruppo idrossilico

- 2503
- 22
- Brigitta Ferrari
Spieghiamo cosa sono un gruppo idrossilico, le sue caratteristiche, la struttura e diversi esempi
 Struttura chimica del gruppo idrossilico
Struttura chimica del gruppo idrossilico Cos'è un gruppo idrossilico?
UN Gruppo idrossilico È un gruppo funzionale o parte di altri gruppi funzionali presenti in molti composti organici e inorganici. È formato da un atomo di idrogeno e uno di ossigeno (da cui il suo nome).
I gruppi idrossilici sono generalmente collegati a un atomo di carbonio o ad un altro elemento non metallico come lo zolfo o il fosforo, tra gli altri, e sono uno dei gruppi funzionali più importanti nella chimica organica.
Questo gruppo di atomi è presente in gruppi funzionali organici come alcoli, fenoli e acidi carbossilici, ed è quello che dà a ciascuno di questi gruppi funzionali le sue caratteristiche delle caratteristiche delle proprietà chimiche. In strutture diverse può essere rappresentato come -oh o ho-
Caratteristiche dei gruppi idrossilici
- È costituito da un atomo di ossigeno e uno di idrogeno collegato tra loro e collegato a un altro atomo in una molecola attraverso legami covalenti.
- Il collegamento tra idrogeno e atomo di ossigeno è un legame polare in cui l'ossigeno ha un carico parziale negativo e un idrogeno a carico parziale positivo, che rende il gruppo idrossile un gruppo funzionale polare.
- Ha una struttura simile a quella dell'acqua. Per questo motivo, molti dei composti che lo contengono sono generalmente solubili in detto solvente.
- Ha un idrogeno direttamente collegato all'atomo di ossigeno, quindi il gruppo idrossilico può formare un legame idrogeno in cui partecipa come gruppo di idrogeno donatore.
- Avendo due elettroni liberi sull'atomo di ossigeno, il gruppo idrossilico può formare due ulteriori legami idrogeno che agiscono come accettore di atomi di idrogeno.
- Puoi agire come acido dando un protone a una base. A seconda del gruppo funzionale di cui è parte e dell'atomo a cui è direttamente collegato, il gruppo idrossilico può mostrare diversi livelli di acidità. Ad esempio, negli alcoli, ha un PKA di 15 o più (acido feroce rispetto all'acqua), nei fenoli varia tra 7 e 10 mentre negli acidi carbossilici di solito è compreso tra 4 e 5.
- Puoi anche agire come una base di Lewis, donando una delle sue coppie di elettroni per collegarsi a un altro protone o ad un altro acido Lewis.
Struttura del gruppo idrossilico
Come menzionato tra le caratteristiche, gli atomi di ossigeno e idrogeno nel gruppo idrossile formano un legame covalente polare.
Inoltre, l'atomo di ossigeno forma un secondo legame covalente con un altro atomo che fa parte di una molecola come alcol, fenolo a qualche altro composto. La struttura Lewis di questo gruppo è presentata di seguito:
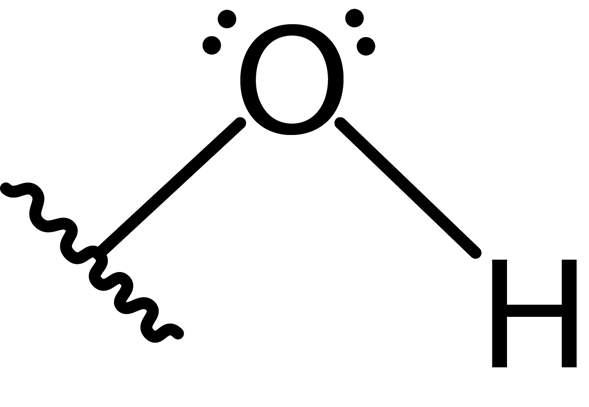
A causa della presenza delle due coppie di elettroni liberi sull'atomo di ossigeno e sui due legami covalenti, il gruppo idrossile ha una geometria angolare con un angolo di circa 104 °, leggermente inferiore all'angolo tetraedrico. La lunghezza del legame di ossigeno-idrogeno è di circa 0.97 Angstrom.
Gruppo idrossilico, radicale idrossilico e anione idrossido
È molto comune confondere il gruppo idrossil.
Da un lato, il radicale idrossilico differisce dal gruppo idrossilico in cui è un radicale libero con un numero dispari di elettroni di valenza e non è anche collegato a nessun altro atomo o gruppo di atomi (motivo per cui è detto gratuitamente).
Nonostante queste differenze, molte persone usano erroneamente il termine radicale idrossilico per fare riferimento al gruppo idrossile quando presenti in una molecola.
L'anione idrossido, d'altra parte, è uno ione con un carico negativo formato da idrogeno e ossigeno, mentre il gruppo idrossilico è un gruppo neutro.
Inoltre, mentre il gruppo idrossilico è sempre collegato a una molecola mediante un legame covalente, i composti che contengono ioni idrossido hanno un legame ionico tra questo e un po 'di metallo come sodio, litio o potassio.
Può servirti: quali sono l'anodo e il catodo?Esempi di gruppo idrossilico
Alcoli
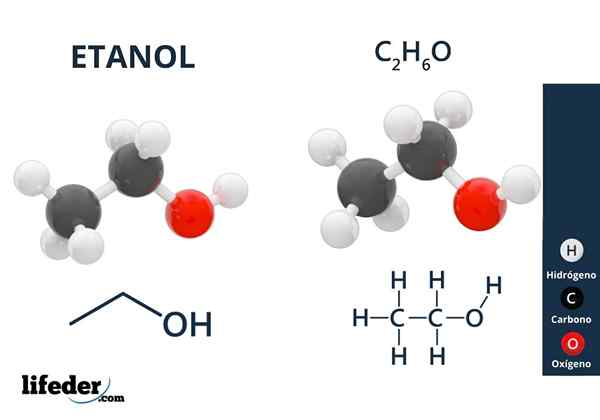 Etanolo
Etanolo Gli alcoli hanno gruppi idrossilici legati a un carbonio alifatico. Esempi di alcoli sono:
- Alcool metilico.
- Etanolo.
- Alcool isopropilico.
Fenoli
I fenoli sono caratterizzati da un gruppo idrossilico direttamente collegato a un anello aromatico. Alcuni esempi di fenoli comuni sono:
- Fenolo.
- Alfa e beta-naftol.
- Orto, obiettivo e per cresol.
Carboidrati
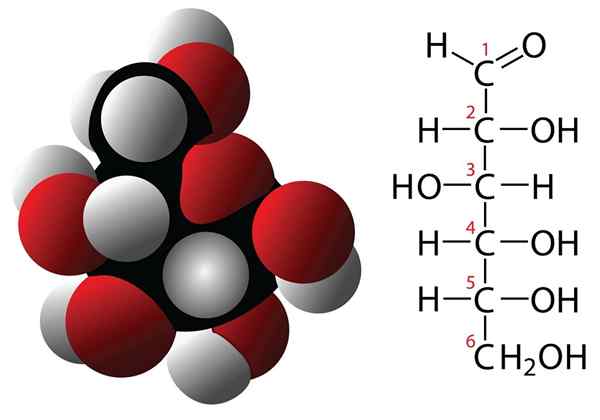 Molecola di glucosio e formula molecolare
Molecola di glucosio e formula molecolare I carboidrati sono composti con 3 o più atomi di carbonio che sono caratterizzati da una formula empirica formata da carboni e molecole d'acqua. Questi composti hanno spesso più gruppi di idrossilli che li rendono molto solubili in acqua. Alcuni esempi di carboidrati sono:
- Glucosio.
- Fruttosio.
- Saccarosio.
Acidi carbossilici
Il gruppo funzionale carbossilico presente negli acidi carbossilici corrisponde a uno dei gruppi funzionali più acidi che una molecola organica può avere. Questi composti sono generalmente acidi deboli quando li confrontano con alcuni acidi minerali, ma possono diventare considerevolmente acidi a seconda della loro struttura.
L'acidità del gruppo carbossilico è dovuta alla presenza di un gruppo idrossile collegato a un gruppo carbonilico, che stabilizza il carico negativo dell'anione che si forma quando l'idrossile produce il suo protone. Alcuni esempi di acidi carbossilici sono:
- Acido acetico.
- Acido benzoico.
- Acido trifluoroacetico.
Acidi solfonici
Gli acidi solfonici sono composti organici che sono formati dalla reazione tra alcuni composti organici e acido solforico o anidride zolfo. Questi tipi di composti hanno un gruppo idrossilico e, in generale, sono acidi piuttosto forti, paragonabili all'acido solforico.
Alcuni esempi di acidi solfonici sono:
- Acido pentosolfonico.
- Ortho, obiettivi e isomeri di acido touensulfonico.
- Acido benzeulfonico.
Acidi inorganici
I gruppi idrossilici non appaiono solo nei composti organici. Molti composti inorganici li possiedono anche, in particolare acidi oxacidi. In questi casi, il gruppo idrossilico è direttamente collegato a un non metal, generalmente diverso da carbonio.
Alcuni esempi di acidi inorganici che hanno gruppi idrossilici insieme al non metal a cui è collegato sono:
- Acido ipocloroso, in cui il gruppo idrossilico è collegato a un atomo di cloro.
- Acido solforico, che ha due gruppi idrossilici legati a un atomo di zolfo.
- Acido fosforico, in cui i tre gruppi idrossilici sono collegati a un atomo di fosforo.

