Caratteristiche del gruppo carbonile, proprietà, nomenclatura, reattività
- 4817
- 981
- Benedetta Rinaldi
Lui Gruppo carbonile È un gruppo funzionale organico e ossigenato che ricorda la molecola di gas monossido di carbonio. È rappresentato come C = O, e sebbene sia considerato organico, può anche essere trovato nei composti inorganici; Come l'acido carbonico, h2Co3, o nei composti organometallici con CO come legame.
Tuttavia, è in chimica del carbonio, vita, biochimica e altri rami scientifici analoghi in cui questo gruppo si distingue per la sua enorme importanza. Se non fosse per lui, molte molecole non potevano interagire con l'acqua; Proteine, zuccheri, aminoacidi, grassi, acidi nucleici e altre biomolecole non esisterebbero se non fosse per questo.
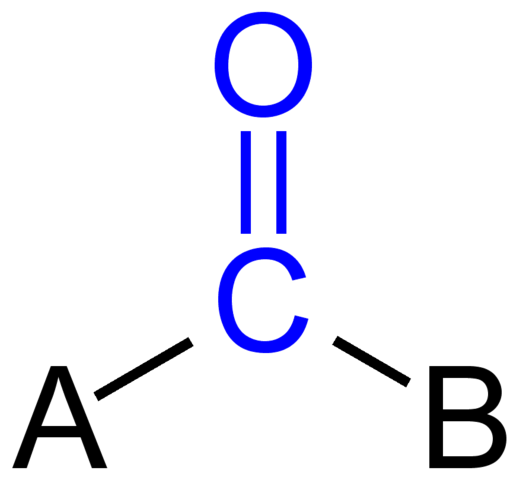
 Gruppo carbonile. Fonte: Jü [dominio pubblico]
Gruppo carbonile. Fonte: Jü [dominio pubblico] L'immagine superiore mostra come questo gruppo appare nello scheletro generale di un composto. Si noti che è evidenziato dal colore blu e se rimuoviamo le sostituzioni a e b (r o r ', altrettanto valida), ci sarebbe una molecola di monossido di carbonio. La presenza di questi sostituenti definisce un gran numero di molecole organiche.
Se A e B sono atomi di carbonio, come metalli o elementi non metallici, è possibile realizzare composti organometallici o inorganici. Nel caso della chimica organica, i sostituenti A e B saranno sempre atomi di idrogeno, linee gassate, con o senza ramificazioni, anelli ciclici o aromatici.
Pertanto, inizia a capire perché il gruppo carbonilico è abbastanza comune per coloro che studiano scienze naturali o di salute; È ovunque, e senza di essa i meccanismi molecolari che si verificano nelle nostre cellule non si verificherebbero.
Se la sua rilevanza potesse essere riassunta, si dice che fornisca polarità, acidità e reattività a una molecola. Dove esiste un gruppo carbonilico, è più che probabile che a quel punto la molecola possa subire una trasformazione. Pertanto, è un sito strategico sviluppare la sintesi organica attraverso ossidazioni o attacchi nucleofili.
[TOC]
Caratteristiche e proprietà del gruppo carbonile
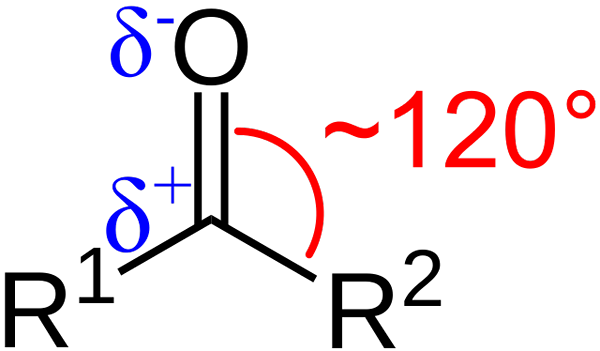 Caratteristiche strutturali del gruppo carbonile. Fonte: Azalina Gomberg [dominio pubblico].
Caratteristiche strutturali del gruppo carbonile. Fonte: Azalina Gomberg [dominio pubblico]. Quali sono le caratteristiche strutturali ed elettroniche del gruppo carbonile? Su1 e r2 Invece di A e B, che esiste tra i sostituenti e l'atomo di ossigeno un angolo di 120 ° C; Cioè, la geometria attorno a questo gruppo è trigonale.
Qual è la geometria tale2; Pertanto, il carbonio avrà tre orbitali SP2 Per formare semplici collegamenti covalenti con R1 e r2, e un orbitale P puro per stabilire doppio legame con ossigeno.
In questo modo viene spiegato come ci può essere un doppio legame c = o.
Se si osserva l'immagine, si vedrà anche che l'ossigeno ha una maggiore densità elettronica, Δ-, rispetto al carbonio, Δ+. Questo perché l'ossigeno è più elettronegativo del carbonio e quindi "ruba" la densità elettronica; E non solo per lui, ma anche per i sostituenti r1 e r2.
Di conseguenza, viene generato un momento di dipolo permanente, che può essere di grande o minore entità a seconda della struttura molecolare. Dove c'è un gruppo carbonilico, ci saranno momenti dipolo.
Strutture di risonanza
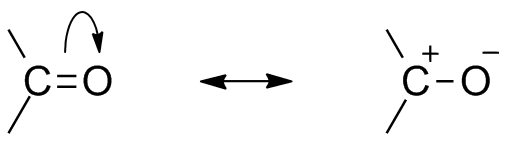 Le due strutture di risonanza per questo gruppo organico. Fonte: Mfomich [CC0]
Le due strutture di risonanza per questo gruppo organico. Fonte: Mfomich [CC0] Un'altra conseguenza dell'elettronegatività dell'ossigeno è che nel gruppo carbonilico ci sono strutture di risonanza che definiscono un ibrido (la combinazione delle due strutture dell'immagine superiore). Si noti che la coppia di elettroni può migrare verso l'orbitale P di ossigeno, che lascia l'atomo di carbonio con un carico parziale positivo; Un carbocalizzazione.
Può servirti: cicloalcano: proprietà, reazioni, usi, esempiEntrambe le strutture si verificano costantemente, quindi il carbonio mantiene una costante carenza di elettroni; cioè, per i cationi che sono molto vicini ad essa sperimenteranno una repulsione elettrostatica. Ma, se si tratta di un anione, o una specie in grado di donare elettroni, sentirà una forte attrazione per questo carbonio.
Allora ciò che è noto come l'attacco nucleofilo, che sarà spiegato in una sezione successiva.
Nomenclatura
Quando un composto ha il gruppo C = O, si dice che sia carbonile. Pertanto, a seconda della natura del composto carbonilico, ha le sue regole di nomenclatura.
Sebbene, indipendentemente da ciò che è, tutti condividono una regola in comune: il C = O ha una priorità nella catena gassata al momento della lista degli atomi di carbonio.
Ciò significa che se ci sono ramificazioni, atomi alogeni, gruppi funzionali azotati, collegamenti doppi o tripli, nessuno di essi può trasportare un numero inferiore a c = o; Pertanto, la catena più lunga inizia ad essere elencata il più vicino possibile al gruppo carbonile.
Se al contrario ci sono diversi c = o nella catena, e uno di essi fa parte di un gruppo funzionale di maggiore gerarchia, allora il gruppo carbonil.
E ciò che si dice gerarchia? Quanto segue, dal più alto al minore:
-Acidi carbossilici, rcooh
-Ester, rcoor '
-Amida, rconh2
-Aldeide, rcoh (o rcho)
-CETONA, RCOR
Sostituzione di R e R 'con segmenti molecolari, infiniti composti carbonilici rappresentati da famiglie sopra: acidi carbossilici, esteri, Amidas, ecc. Ognuno ha associato la sua nomenclatura tradizionale o iupac.
Reattività
Attacco nucleofilo
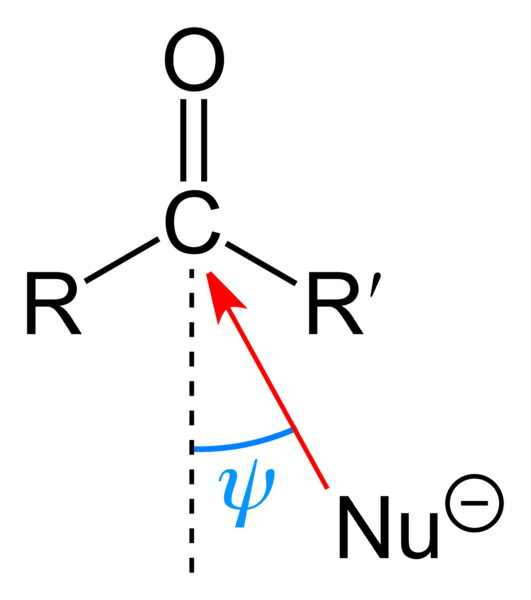 Attacco nucleofilo al gruppo carbonilico. Fonte: Benjah-BMM27 [dominio pubblico]
Attacco nucleofilo al gruppo carbonilico. Fonte: Benjah-BMM27 [dominio pubblico] L'immagine superiore mostra l'attacco nucleofilo subito dal gruppo carbonilico. Il nucleofilo, nu-, Può essere un anione o una specie neutra con elettroni disponibili; Come l'ammoniaca, NH3, Per esempio. Questo sembra esclusivamente al carbonio perché, secondo le strutture di risonanza, presenta un carico parziale positivo.
Il carico positivo attira Nu-, che cercherà di avvicinarsi a un "fianco" in modo tale che ci sia il minimo impedimento sterico da parte dei sostituenti R e R '. A seconda di quanto sono ingombranti o delle dimensioni della stessa NU-, L'attacco si verificherà a diversi angoli ψ; Può essere molto aperto o chiuso.
Una volta che l'attacco si è formato, verrà formato un composto intermedio, Nu-Cr'-o-; Cioè, l'ossigeno rimane con un paio di elettroni per consentire l'aggiunta di NU- al gruppo carbonilico.
Questo ossigeno caricato negativamente può intervenire in altri passaggi della reazione; Proton come gruppo idrossilico, OH, o rilascio come una molecola d'acqua.
Può servirti: coefficiente di partizione: distribuzione, distribuzione, applicazioniI meccanismi coinvolti, così come i prodotti della reazione ottenuti da questo attacco, sono molto vari.
Derivati
L'agente nulyico Nu- Può essere molte specie. Per ogni specifico per reagire con il gruppo carbonilico, diversi derivati.
Ad esempio, quando detto agente nucleofilo è un'ammina, NH2A, iminas originata, r2C = nr; Se è idrossilammina, NH2Oh, si traduce in oximas, rr'c = noh; Se è l'anione cianuro, CN-, Cianoidrina, rr'c (OH) CN, e quindi con altre specie.
Riduzione
Inizialmente si diceva che questo gruppo fosse ossigenato, e quindi arrugginito. Ciò significa che, date le condizioni, i collegamenti possono essere ridotti o perdere l'atomo di ossigeno che lo sostituisce con gli idrogeni. Per esempio:
C = o => ch2
Questa trasformazione indica che il gruppo carbonilico era ridotto a un gruppo di metilene; C'è stato un guadagno di idrogeno a causa della perdita di ossigeno. In termini chimici più appropriati: il composto carbonile è ridotto a un alcano.
Se è un cetona, rcor ', in presenza di idraracina, h2N-nh2, e un ambiente fortemente fondamentale può essere ridotto al rispettivo alcano; Questa reazione è nota come riduzione di Wolff-Kishner:
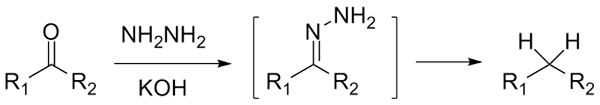 Riduzione di Wolff-Kishner. Fonte: Jü [CC0]
Riduzione di Wolff-Kishner. Fonte: Jü [CC0] Se d'altra parte la miscela di reazione è costituita da zinco amalgamato e acido cloridrico, la reazione è nota come riduzione di Clemmensen:
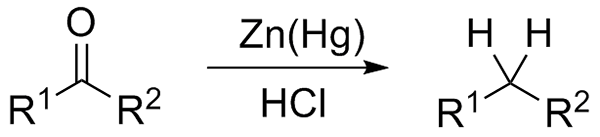 Riduzione di Clemmensen. Fonte: Wikimedia Commons.
Riduzione di Clemmensen. Fonte: Wikimedia Commons.
Allenamento acetale e ceo
Il gruppo carbonilico può non solo aggiungere agenti nucleofili NU-, Ma in condizioni acide può anche reagire con gli alcoli attraverso meccanismi simili.
Quando un aldeide o Cetona reagiscono parzialmente con un alcol, emiacetali o emiceti, rispettivamente. Se la reazione viene eseguita completamente, i prodotti sono acetali e ketali. Le seguenti equazioni chimiche riassumono e chiariscono il nuovo menzionato:
RCHO + R3Oh g rchoh (o3) (Emiacetal) + r4Oh g rch (o3) (O4) (Acetal)
Rcor2 + R3Oh g rcor2(Oh) (o3) (Emico) + r4Oh g rcor2(O3) (O4) (ketal)
La prima reazione corrisponde alla formazione di emiacetali e acetali da un aldeide e il secondo di emiceti e chetali da un chetone.
Queste equazioni non sono abbastanza semplici da spiegare la formazione di questi composti; Tuttavia, per un primo approccio all'argomento è sufficiente capire che vengono aggiunti gli alcoli e che le loro catene laterali R (R (R (R (R3 e r4) Sono collegati al carbonio carbonilico. Ecco perché o o3 e o4 Alla molecola iniziale.
La differenza principale tra un acetale e ketal, è la presenza dell'atomo di idrogeno collegato al carbonio. Si noti che il chetone manca di questo idrogeno.
Ragazzi
Molto simile come spiegato nella sezione Nomenclature per il gruppo carbonilico, i suoi tipi si basano su quelli che sono i sostituenti A e B o R e R '. Pertanto, ci sono caratteristiche strutturali che condividono una serie di composti carbonilici oltre solo l'ordine o il tipo di collegamenti.
Ad esempio, è stata fatta menzione al principio di analogia tra questo gruppo e il monossido di carbonio, cistico. Se la molecola è priva di atomi di idrogeno e se ci sono anche due terminali C = O, sarà quindi un ossido di carbonio, cNO2. Per n uguale a 3, avrai:
Può servirti: isóbarosO = c = c = c = o
Che è come se ci fossero due molecole di Cà collegate e separate da un carbonio.
I composti carbonilici non possono solo derivare dal gas CO, ma anche dall'acido carbonico, H2Co3 o oh- (c = o) -oh. Qui i due OH rappresentano R e R 'e sostituendo uno di essi, o i loro idrogeni, si ottengono derivati dell'acido carbononico.
E poi ci sono derivati di acidi carbossilici, rcooh, ottenuti cambiando le identità R o sostituendo H con un altro atomo o catena R '(che darebbe origine a un estere, rcoor').
Come identificarlo in aldeidi e chetoni
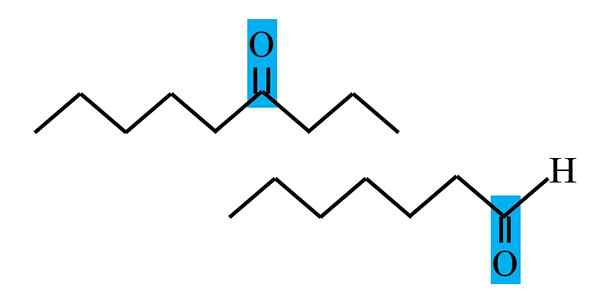 Differenziazione del chetone e dell'aldeide da una formula strutturale. Fonte: Gabriel Bolívar.
Differenziazione del chetone e dell'aldeide da una formula strutturale. Fonte: Gabriel Bolívar. Sia aldeidi che chetoni hanno in comune la presenza del gruppo carbonile. Le sue proprietà chimiche e fisiche sono dovute. Tuttavia, i loro ambienti molecolari non sono uguali in entrambi i composti; Nel primo è in una posizione terminale e nei secondi, ovunque nella catena.
Ad esempio, nell'immagine superiore il gruppo carbonile si trova all'interno di una scatola bluastra. Nei chetoni, accanto a questa scatola ci deve essere un altro segmento di carbonio o catena (capovolto); Mentre nelle aldeidi, può esserci solo un atomo di idrogeno (sotto).
Se il c = o è a un'estremità della catena, sarà un aldeide; Questo è il modo più diretto per differenziarlo da una Cetona.
ID
Ma come conoscere sperimentalmente se un composto sconosciuto è un aldeide o un chetone? Esistono numerosi metodi, dall'assorbimento spettroscopico (a infrarossi radiazioni, IR) o test qualitativi organici.
Per quanto riguarda i saggi qualitativi, questi si basano su reazioni che quando dà positivo l'analista osserverà una risposta fisica; Un cambio di colore, rilascio di calore, formazione di bolle, ecc.
Ad esempio, aggiungendo al campione una soluzione acida di K2Cr2O7 L'aldeide verrà trasformata in acido carbossilico, il che fa cambiare il colore della soluzione da arancione al verde (test positivo). Nel frattempo, i chetoni non reagiscono e, pertanto, l'analista non osserva alcun cambiamento di colore (test negativo).
Un altro studio è usare il reagente Tollens, [AG (NH3)2"+, in modo che l'aldeide riduca i cationi AG+ All'argento in metallo. E il risultato: la formazione di uno specchio d'argento nella parte inferiore del tubo di prova in cui è stato posizionato il campione.
Esempi principali
Infine, verranno elencate una serie di esempi di composti carbonilici:
-Cap3COOH, acido acetico
-Hcooh, acido formico
-Cap3Coch3, Propanona
-Cap3Coch2Cap3, 2-butanone
-C6H5Coch3, acetofenone
-Cap3Cho, etanale
-Cap3Cap2Cap2Cap2Cho, pentanal
-C6H5Cho, Benzaldeide
-Cap3Conh2, acetamide
-Cap3Cap2Cap2Cooch3, Propil acetato
Ora, se vengono citati esempi di composti che possiedono semplicemente questo gruppo, l'elenco sarebbe quasi infinito.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. Ammine. (10a edizione.). Wiley Plus.
- Reid Danielle. (2019). Gruppo carbonile: proprietà e panoramica. Studio. Recuperato da: studio.com
- Sharleen Agvateesiri. (5 giugno 2019). Il gruppo carbonilico. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Wiki Kids Ltd. (2018). Composti carbonilici. Recuperato da: semplicemente.Scienza
- Toppr. (S.F.). Nomenclatura e struttura del gruppo carbonile. Recuperato da: toppr.com
- Clark J. (2015). Ossidazione di aldeidi e chetoni. Recuperato da: ChemGuide.co.UK

