Carbon 12 notazione nucleare, storia, commenti
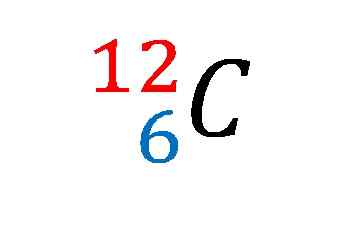
- 2115
- 441
- Benedetta Rinaldi
Lui Carbon-12 È l'isotopo più abbondante dell'elemento in carbonio, con abbondanza del 98,93%. Inoltre, è principale responsabile di tutte le proprietà e applicazioni attribuite all'elemento carbonio.
Lui 12C Con una massa atomica di esattamente 12 Dalton, funge da riferimento per l'istituzione delle masse atomiche del resto dei nucleidi. L'atomo di 12C è composto da sei protoni, neutroni ed elettroni; Tuttavia, la massa di elettroni è considerata trascurabile.
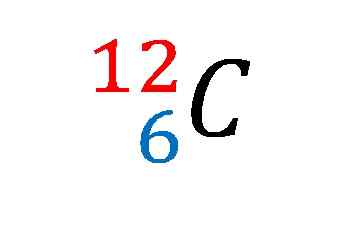 Notazione nucleare per l'isotopo di carbonio-12. Fonte: Gabriel Bolívar
Notazione nucleare per l'isotopo di carbonio-12. Fonte: Gabriel Bolívar Gli elementi di solito hanno masse atomiche espresse come numeri interi, seguiti da decimali, perché gli elementi possono avere diversi isotopi stabili.
Pertanto, le masse atomiche degli elementi sono espresse come media ponderata delle masse atomiche dei loro diversi isotopi. Tenendo conto che il 12C ha un'abbondanza del 98,93%e il 13C Un'abbondanza dell'1,15%, la massa atomica di carbonio è 12.011 Dalton.
La massa atomica di un elemento è espressa come media delle masse atomiche dei suoi diversi atomi in relazione alle dodici parte della massa del 12C, conosciuta come unità unificata di massa atomica; Precedentemente abbreviato come "Uma" e attualmente come "U".
[TOC]
Notazione nucleare
Nell'immagine superiore è stata mostrata la notazione nucleare o il simbolo per l'isotopo di carbonio-12.
Descriverlo è lo stesso di sedersi le caratteristiche dell'atomo di carbonio per eccellenza. Il suo numero atomico 6 indica il numero di protoni nel suo nucleo. Il numero 12 è uguale alla somma di protoni e neutroni, e quindi si tratta di massa atomica; che è proporzionale alla massa nucleare.
Può servirti: ossido di ferroE sebbene questa notazione non lo mostri, ci sono 6 elettroni che contrastano il carico positivo dei protoni nel nucleo. Dal punto di vista dei legami chimici, quattro di questi sei elettroni sono quelli che stabiliscono le basi della vita come la conosciamo.
Storia
Le indagini di Dalton (1810) hanno sottolineato che l'acqua conteneva una percentuale di ossigeno dell'87,7% e del 12,5% di idrogeno. Ma Dalton ha detto che la formula dell'acqua era oh. Davy e Berzelius (1812) hanno corretto la formula dell'acqua a H2O.
Successivamente, Berzelius ha trovato una composizione della seguente acqua: ossigeno 88,8% e idrogeno 11,2%. Ha considerato che il peso atomico dell'idrogeno è di 1 g e l'ossigeno di 16 g.
Quindi, si sono resi conto che usando il peso atomico di 1 g per idrogeno, il peso atomico dell'ossigeno sarebbe di 15,9 g. Questo motivo, tra gli altri, ha portato a stabilire la massa atomica di 16 g di ossigeno come standard di riferimento per le masse atomiche dei diversi elementi chimici.
L'ossigeno fu usato come modello di riferimento dalla fine del XIX secolo fino al 1961, quando fu deciso di usare il carbonio come standard di riferimento per l'istituzione delle masse atomiche dei diversi elementi.
Prima del 1959, l'IUPAP e l'IUPAC usavano l'elemento di ossigeno per definire il mola nel modo seguente: 1 mol è il numero di atomi di ossigeno presenti in 16 g.
Commenti generali
Parlare di 12C è fare riferimento al carbonio nel suo insieme; o almeno, il 98% della sua essenza, che è sufficiente per tale approssimazione. Questo è il motivo per cui questo isotopico manca di uso in sé, mentre l'elemento come tale, e i solidi che integrano centinaia di applicazioni.
Può servirti: soluzioni apprezzateTuttavia, va notato che gli organismi viventi hanno una preferenza speciale per questo isotopo che dal 13C; cioè la percentuale di 13C o la relazione 12C/13C varia a seconda di ecosistemi, regioni o specie animali.
Ciò può essere dovuto al fatto che molecole con troppi atomi di 13C, più pesante, ostacola o danneggiare i processi metabolici e il funzionamento delle cellule del corpo; anche se la percentuale di 13C Negli esseri viventi era poco più alto dell'1%.
quindi, il 12C è l'isotopo del carbonio responsabile della vita. E il 14C il "tempo del tempo" dei suoi resti, grazie al suo decadimento radioattivo.
Un'altra utilità indiretta di 12C è creare "contrasto" per la tecnica di spettroscopia di risonanza magnetica nucleare del 13C, con cui può essere chiarita la struttura gassata dei composti organici (scopri e build).
Riferimenti
- Phillips, basilico. (8 luglio 2019). Qual è l'isotopo comune di carbonio? Scientifico.com. Recuperato da: scientifici.com
- César Tomé López. (2019). Di pesi atomici. Estratto da: Culturacientifica.com
- Elsevier. (2019). Carbon-12. Scienceirect. Estratto da: ScienceDirect.com
- R. nave. (S.F.). Notazione nucleare. Recuperato da: iperfisica.Phy-Astr.GSU.Edu
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- « Caratteristiche del gruppo carbonile, proprietà, nomenclatura, reattività
- Biografia di Heriberto Frías, stile, opere »

