Concetto di geometria molecolare, tipi ed esempi
- 2485
- 513
- Enzo De Angelis
IL Geometria molecolare O struttura molecolare È la distribuzione spaziale degli atomi attorno a un atomo centrale. Gli atomi rappresentano regioni in cui esiste un'alta densità elettronica e sono quindi considerati gruppi elettronici, indipendentemente dai collegamenti che si formano (semplici, doppi o tripli).
La geometria molecolare di un elemento può caratterizzare alcune delle sue proprietà fisiche o chimiche (punto di ebollizione, viscosità, densità, ecc.). Ad esempio, la struttura molecolare dell'acqua determina la sua solubilità.
 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Questo concetto nasce dalla combinazione e dai dati sperimentali di due teorie: quella del Link Valencia (TEV) e la repulsione delle coppie elettroniche dello strato di Valencia (RPECV). Mentre il primo definisce i collegamenti e i loro angoli, il secondo stabilisce la geometria e, di conseguenza, la struttura molecolare.
Quali forme geometriche sono in grado di adottare molecole? Le due teorie precedenti contribuiscono con le risposte. Secondo l'RPECV, gli atomi e le coppie di elettroni liberi devono essere disposti nello spazio in modo tale che la repulsione elettrostatica tra loro diminuisca al massimo.
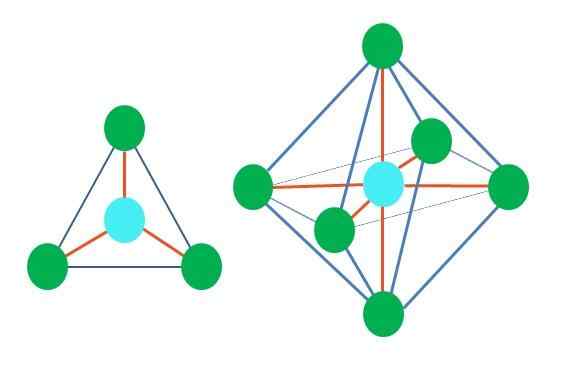
Quindi, le forme geometriche non sono arbitrarie, ma cercano il design più stabile. Ad esempio, nell'immagine superiore può essere visto un triangolo a sinistra e a destra un ottaedro. I punti verdi rappresentano gli atomi e le strisce arancioni i collegamenti.
Nel triangolo, i tre punti verdi sono orientati in una separazione di 120º. Questo angolo, che è uguale a quello del collegamento, consente agli atomi di respingersi il più possibile. Pertanto, una molecola con un atomo centrale attaccato ad altri tre adotterà una geometria trigonale piatta.
Tuttavia, l'RPECV prevede che una coppia di elettroni liberi nell'atomo centrale distorcerà la geometria. Nel caso del piano trigonale, questa coppia spingerà verso il basso i tre punti verdi, risultando in una geometria piramidale trigonale.
Lo stesso può accadere anche con l'ottaedro dell'immagine. In tutto ciò che gli atomi sono separati nel modo più stabile possibile.
[TOC]
Come sapere in anticipo la geometria molecolare di un atomo x?
Per questo, è anche necessario considerare gli elettroni liberi come gruppi elettronici. Questi, insieme agli atomi, definiranno ciò che è noto come il Geometria elettronica, che è un compagno inseparabile della geometria molecolare.
Dalla geometria elettronica e dopo aver rilevato le coppie di elettroni liberi mediante la struttura di Lewis, si può stabilire quale sarà la geometria molecolare. La somma di tutte le geometrie molecolari fornirà uno schizzo della struttura globale.
Tipi di geometria molecolare
Come si può vedere nell'immagine principale, la geometria molecolare dipende da quanti atomi circondano l'atomo centrale. Tuttavia, se un paio di elettroni sono presenti senza condivisione, modificherà la geometria perché occupa molto volume. Pertanto, esercita un effetto sterico.
Secondo questo, la geometria può presentare una serie di forme caratteristiche per molte molecole. Ed è qui che sorgono i diversi tipi di geometria molecolare o struttura molecolare.
Quando la geometria è uguale alla struttura? Entrambi indicano lo stesso solo nei casi in cui la struttura non ha più di un tipo di geometria; Altrimenti, tutti i tipi presenti devono essere considerati e dare alla struttura un nome globale (lineare, ramificato, globulare, piatto, ecc.).
Può servirti: HydraceLe geometrie sono particolarmente utili per spiegare la struttura di un solido dalle sue unità strutturali.
Lineare
Tutti i legami covalenti sono direzionali, quindi il collegamento A-B è lineare. Ma la molecola sarà lineare2? In tal caso, la geometria è semplicemente rappresentata come: B-A-B. I due atomi B sono separati da un angolo di 180º e secondo il TEV, A deve avere orbitali ibridi.
Angolare
 Fonte: Gabriel Bolívar
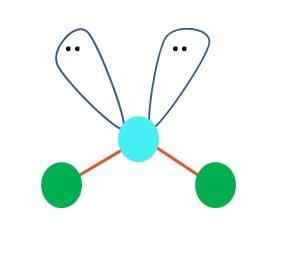
Fonte: Gabriel Bolívar Una geometria lineare per la molecola AB può essere assunta in prima istanza2; Tuttavia, è essenziale disegnare la struttura di Lewis prima di raggiungere una conclusione. Disegnato la struttura Lewis, è possibile identificare il numero di coppie di elettroni non comuni (:) sull'atomo di a.
Quando è così, sulle coppie di elettroni i due atomi di B verso il basso, cambiando i loro angoli. Di conseguenza, la molecola lineare B-A-B finisce per diventare una V, un boomerang o una geometria angolare (immagine superiore)
La molecola d'acqua, H-O-H, è l'esempio ideale per questo tipo di geometria. Nell'atomo di ossigeno ci sono due coppie di elettroni senza condivisione che sono orientati ad un angolo approssimativo di 109º.
Perché questo angolo? Perché la geometria elettronica è tetraedrica, che ha quattro vertici: due per atomi H e due per elettroni. Nell'immagine superiore, nota che i punti verdi e i due "lobi con gli occhi" disegnano un tetraedro con il punto bluastro al centro.
Se o non avessero elettroni liberi, l'acqua formarebbe una molecola lineare, la sua polarità diminuirebbe e gli oceani, i mari, i laghi, ecc., Probabilmente non esisterebbero perché si conoscono.
Tetraedrico
 Fonte: Gabriel Bolívar
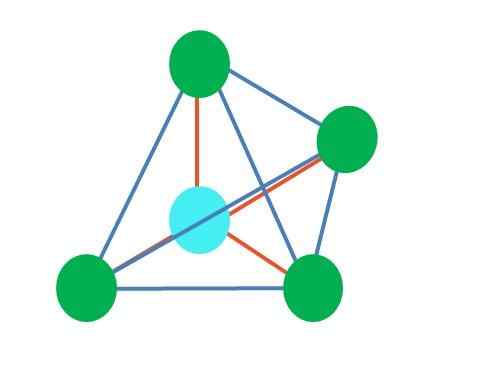
Fonte: Gabriel Bolívar L'immagine superiore rappresenta la geometria tetraedrica. Per la molecola d'acqua, la sua geometria elettronica è tetraedrica, ma eliminando coppie senza elettroni si può notare che si trasforma in una geometria angolare. Questo è anche semplicemente osservato eliminando due punti verdi; I restanti due disegnano la V con il punto blu.
E se al posto di due paia di elettroni liberi ce n'erano solo uno? Poi ci sarebbe un piano trigonale (immagine principale). Tuttavia, eliminando un gruppo elettronico, l'effetto sterico prodotto dalla coppia di elettroni liberi non viene evitato. Pertanto, distorce il piano trigonale a una piramide di base triangolare:
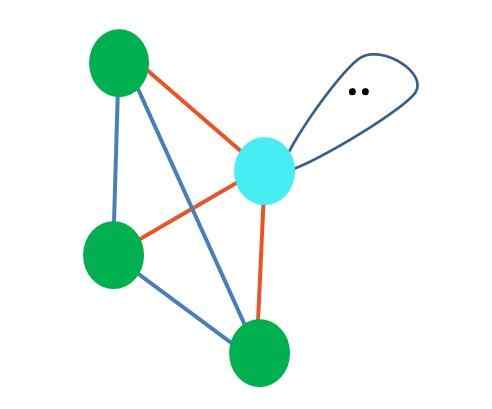 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Sebbene la geometria molecolare trigonale e piramide tetraedrica sia diversa, la geometria elettronica è la stessa: tetraedrico. Quindi la piramide trigonale non conta come geometria elettronica?
La risposta è no, poiché è il prodotto della distorsione causata dal "lobo con gli occhi" e dal suo effetto sterrico.
Per questo motivo, è sempre importante determinare la prima geometria elettronica con l'aiuto delle strutture di Lewis prima di definire la geometria molecolare. La molecola di ammoniaca, NH3, È un esempio di geometria molecolare piramide trigonale, ma con geometria elettronica tetraedrica.
Bipiramide trigonale
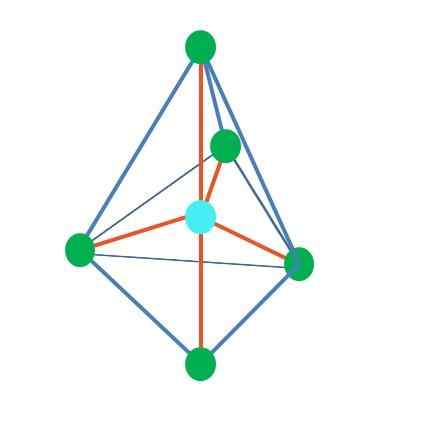 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Fino ad ora, ad eccezione della geometria lineare, nella piramide tetraedrica, angolare e trigonale i loro atomi centrali hanno l'ibridazione SP sp3, Secondo il TEV. Ciò significa che se i suoi angoli di collegamento sono stati determinati sperimentalmente, dovrebbero essere circa 109º.
Può servirti: chimica applicata: oggetto di studio, rami, importanza, esempiDalla geometria difarmidica trigonale, ci sono cinque gruppi elettronici attorno all'atomo centrale. Nell'immagine superiore puoi vedere con i cinque punti verdi; tre nella base triangolare e due in posizioni assiali, che sono i vertici superiori e inferiori della piramide.
Ciò che l'ibridazione ha quindi il punto blu? Ha bisogno di cinque orbitali ibridi per formare legami semplici (arancioni). Questo lo raggiunge attraverso i cinque orbitali SP3D (Prodotto della miscela di una S orbitale, tre P e una d).
Quando si considera cinque gruppi elettronici, la geometria è già esposta, ma con coppie di elettroni senza condividere, subisce di nuovo distorsioni che generano altre geometrie. Allo stesso modo, sorge la seguente domanda: queste coppie possono occupare qualsiasi posizione della piramide? Questi sono: l'Assiale o l'equatoriale.
Posizioni assiali ed equatoriali
I punti verdi che compongono la base triangolare sono in posizioni equatoriali, mentre i due alle estremità superiore e inferiore, in posizioni assiali. Dove preferirà preferibilmente la coppia di elettroni senza condividere? In quella posizione che diminuisce alla massima repulsione elettrostatica e all'effetto sterico.
In posizione assiale la coppia di elettroni farebbe "pressione" perpendicolare (90º) sulla base triangolare, mentre se fosse in posizione equatoriale, i gruppi elettronici rimanenti della base verrebbero separati e premere le due estremità a 90º (anziché invece di tre, come con la base).
Pertanto, l'atomo centrale cercherà di guidare i suoi pari liberi da elettroni in posizioni equatoriali per generare geometrie molecolari più stabili.
Oscillare e forma di t
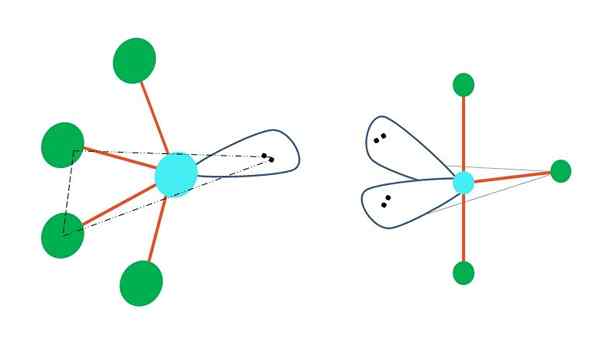 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Se uno o più dei suoi atomi liberi da elettroni fossero sostituiti nella geometria bipirramidica trigonale, avrebbero anche diverse geometrie molecolari.
A sinistra dell'immagine superiore, la geometria cambia nella forma oscillante. In esso, la coppia senza elettroni spinge il resto dei quattro atomi verso la stessa direzione, piegando i loro legami a sinistra. Si noti che questa coppia e due atomi si trovano sullo stesso piano triangolare della bipiramide originale.
E a destra dell'immagine, la geometria a forma di t. Questa geometria molecolare è il risultato della sostituzione di due atomi con due coppie di elettroni, risultando che i restanti tre atomi si allineano nello stesso piano che disegna esattamente una lettera t.
Quindi, per una molecola di tipo AB5, Questo adotta geometria bipiramidale trigonale. Tuttavia, ab4, Con la stessa geometria elettronica, adotterà una geometria oscillante; e ab3, Geometria a forma di T. In tutti questi avranno (generalmente) ibridazione SP3D.
Per determinare la geometria molecolare è necessario disegnare la struttura di Lewis e quindi la sua geometria elettronica. Se questa è bipiramide trigonale, le coppie senza elettrone verranno quindi scartate, ma non i loro effetti sterici sul resto degli atomi. Pertanto, può essere perfettamente discernendo tra le tre possibili geometrie molecolari.
Ottaedrico
A destra dell'immagine principale, è rappresentata la geometria molecolare ottaedrica. Questo tipo di geometria corrisponde ai composti AB6. Ab4 Formano la base quadrata, mentre le restanti due B si posizionano in posizioni assiali. Pertanto, si formano diversi triangoli equilaterali, che sono i volti dell'ottaedro.
Può servirti: energia di attivazioneQui, ancora una volta, potrebbero esserci (come in tutte le geometrie elettroniche) coppie di elettroni liberi e quindi derivano da questo fatto altre geometrie molecolari. Ad esempio, AB5 Con geometria elettronica octronistica è costituito da una piramide con base quadrata e AB4 di un piano quadrato:
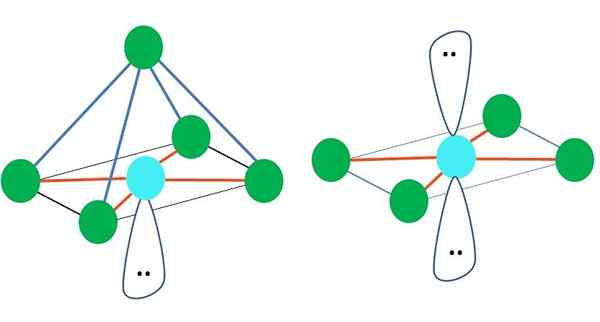 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Nel caso della geometria elettronica octronistica, queste due geometrie molecolari sono le più stabili in termini di repulsione elettrostatica. Nella geometria piatta quadrata le due coppie di elettroni sono separate 180º.
Cos'è l'ibridazione per l'atomo in queste geometrie (o strutture, se è l'unica)? Ancora una volta, il TEV stabilisce che è SP3D2, Sei orbitali ibridi, che consentono di guidare i gruppi elettronici nei vertici di un ottaedro.
Altre geometrie molecolari
Modifica delle basi delle piramidi menzionate finora, è possibile ottenere alcune geometrie molecolari più complesse. Ad esempio, la bipiramide pentagonale si basa su un Pentagono e i composti che formano la formula generale AB7.
Come le altre geometrie molecolari, la sostituzione di atomi B con coppie senza elettrone distorcerà la geometria in altre forme.
Inoltre, i composti AB8 Possono adottare geometrie come l'antiprismo quadrato. Alcune geometrie possono diventare molto complicate, specialmente per le formule AB7 Da ora in poi12).
Esempi di geometria molecolare
Una serie di composti sarà menzionata di seguito per ciascuna delle principali geometrie molecolari. Come esercizio, le strutture di Lewis potrebbero essere disegnate per tutti gli esempi e certificare se, data la geometria elettronica, si ottengono geometrie molecolari come sono elencate di seguito.
Geometria lineare
-Etilene, h2CESS2
-Cloruro di berillio, becl2 (Cl-be-cl)
-Anidride carbonica, co2 (O = c = o)
-Azoto, n2 (N /n)
-Mercury Dibromure, HGBR2 (BR-HG-BR)
-Triyoduro anion, io3- (I-i-i)
-Acido madedric, HCN (H-NESCI)
I suoi angoli devono essere di 180º e quindi avere ibridazione SP.
Geometria angolare
-Acqua
-Biossido di zolfo, quindi2
-Biossido di azoto, no2
-Ozono, o3
-Amiduro anion, NH2-
Piatto trigonale
-Bromo trifluoride, bf3
-Tricloruro di alluminio, ALCL3
-Nitrato anione, no3-
-Carbonato anione, co32-
Tetraedrico
-GAS METANO, CH4
-Tetracloruro di carbonio, CCL4
-Catione di ammonio, NH4+
-Solfato anione, così42-
Piramide trigonale
-Ammoniaca, NH3
-Idronio cation, h3O+
Bipiramide trigonale
-Fosforo pentafluororo, pf5
-Pentacloruro antimonio, SBF5
Oscillante
Tetrafluoride di zolfo, SF4
Forma di t
-Tricloruro di iodio, ICL3
-Trifluoro di cloro, CLF3 (Entrambi i composti sono noti come interalogeni)
Ottaedrico
-Hexafluororo di zolfo, SF6
-Selenio hexafluororo, sef6
-Esaflofosfato, pf6-
Per culminare, la geometria molecolare è quella che spiega le osservazioni delle proprietà chimiche o fisiche della questione. Tuttavia, è orientato in base alla geometria elettronica, in modo che quest'ultimo debba essere sempre determinato prima del primo.
Riferimenti
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). Cengage Learning, p 194-198.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione., P. 23, 24, 80, 169). Mc Graw Hill.
- Mark E. Tuckerman. (2011). Geometria molecolare e teoria VSEPR. Recuperato da: NYU.Edu
- Chembook virtuale, Charles e. Ophardt. (2003). Introduzione alla geometria molecolare. Recuperato da: chimica.Elmhursst.Edu
- Chimica librettexts. (8 settembre 2016). Geometria delle molecole. Recuperato da: Chem.Librettexts.org
- « Modelli di insegnamento pedagogico (tradizionale e corrente)
- I 25 giochi tradizionali più popolari »

