Struttura del fulmina di mercurio, proprietà, ottenimento, usi
- 2945
- 112
- Dott. Rodolfo Gatti
Lui Mercurio Fulminato È un composto inorganico formato da elementi di mercurio (Hg), carbonio (c), azoto (N) e ossigeno (O) (O). La sua formula chimica è Hg (CNO)2. Non dovrebbe essere confuso con Mercury cyanato, perché sebbene entrambi i composti abbiano gli stessi elementi, in questi ultimi gli atomi si legano in modo diverso.
Fu scoperto dal chimico inglese Edward Howard nel 1800. Tuttavia, quasi 200 anni prima di essere stato accidentalmente sintetizzato dall'alchemistico tedesco Johannes Kunckel, che per l'esplosione non lo ha isolato, ma ha lasciato i registri scritti degli ingredienti utilizzati.
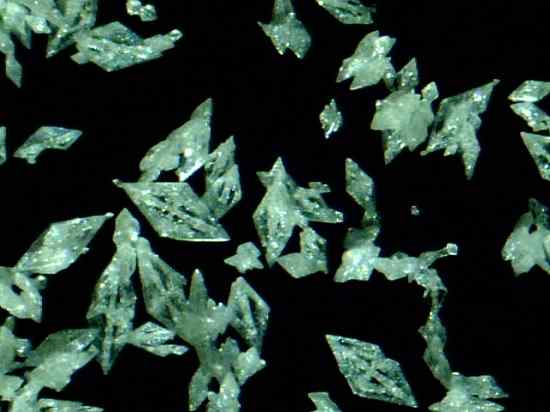
 Mercury Fulminat Crystals Hg (CNO)2. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
Mercury Fulminat Crystals Hg (CNO)2. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. È un esplosivo primario, quindi viene utilizzato in percussioni o capsule di esplosione per promuovere l'esplosione di altre sostanze. Sebbene la sua preparazione e conservazione sia estremamente pericolosa, è stata ampiamente usata nel diciannovesimo secolo come detonatore in guerra e caccia alle armi.
È attualmente utilizzato per la detonazione di potenti carichi di dinamite nella costruzione di tunnel e strade e mining.
È chiaramente un composto estremamente pericoloso che può essere manipolato solo da persone con una profonda conoscenza di come gestire gli esplosivi.
[TOC]
Struttura
The Hg (CNO)2 È un sale acido fulminico hcno. Contiene mercurio nell'ossidazione +2 e due unità Fulminate CNO-.
Secondo uno studio a raggi X condotto nel 2007 in Germania (riportato in inglese nel 2008), le molecole di fulminato di mercurio hanno la struttura ONC-HG-CNO, dove si osserva che il mercurio è direttamente legato agli atomi di carbonio.
L'unione C-HG-C è lineare; forma un angolo di 180 ° e il gruppo Fulminat (CNO) ha un breve legame con il carbonio-nitrogeno e un legame più lungo di azoto-ossigeno.
La lunghezza del collegamento C-N è 1.14-1.17 Å (angstroms), che corrisponde a un triplo collegamento debole. Il collegamento N-O è 1,20-1,25 Å che indica un doppio legame debole. Un angstrom (Å) è una misura di lunghezza ed è la parte di dieci melon di un metro.
Può servirti: metodi di separazione delle miscele omogenee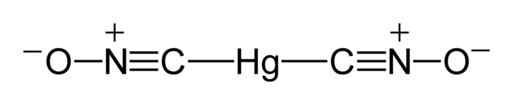 Struttura di Lewis di Mercurio Fulminato. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons.
Struttura di Lewis di Mercurio Fulminato. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons. A stato solido Sebbene l'Unione C-HG-C sia lineare e anche il gruppo CNO è, l'Unione N-C-HG si discosta dalla linearità in 11 °, cioè ha un angolo di 169 °.
 Molecole Hg (CNO)2 In stato solido. Grigio = mercurio; Nero = carbonio; blu = azoto; Rosso = ossigeno. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons.
Molecole Hg (CNO)2 In stato solido. Grigio = mercurio; Nero = carbonio; blu = azoto; Rosso = ossigeno. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons. Tuttavia, secondo lo studio di cui sopra, in stato gassoso la molecola completa è totalmente lineare.
Nomenclatura
- Mercurio Fulminato
- Fulminato mercurico
- Mercurio Diffulmine
- Mercurio bisfulminato
- Sale di mercurio acido fulminico
- Mercurio fulminante
- Mercurio esplosivo
Proprietà
Stato fisico
Solido da bianco a arancione solido.
 HG (CNO)2 solido inumidito. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
HG (CNO)2 solido inumidito. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. Peso molecolare
284,63 g/mol
Punto di fusione
Non si scioglie. Essere riscaldato a più di 100 ° C exploit.
Densità
4,42 g/cm3
Solubilità
Leggermente solubile in acqua. Solubile in etanolo (c2H5OH) e idrossido di ammonio (NH4OH).
Proprietà chimiche
È un composto molto esplosivo e altamente sensibile a colpi, impatti o attriti. Puoi facilmente far esplodere con scintille e fiamme. Quando si decompone per i gas di mercurio di forma (Hg), monossido di carbonio (CO) e azoto (N2).
Con acido solforico (h2SW4) Il concentrato si verifica anche una violenta detonazione. L'acido cloridrico lo dissolve parzialmente e si verifica il cloruro mercurico.
Secondo uno studio condotto nel 1981, se subisce un riscaldamento controllato e molto lento, sotto un'atmosfera inerte di argon, quando raggiunge i 120 ° C si verifica una decomposizione non esplosiva e si formano ossido mercurico solido e gas mercurici.
È un composto che è stato studiato da tempi rari per il suo pericolo e tali opportunità di studio sono state molto distanziate l'una dall'altra nel tempo. Devi lavorare al buio per evitare esplosioni. I suoi campioni dovrebbero essere tenuti sott'acqua e senza luce.
 Hg Solid (CNO)2 Mantieni sott'acqua. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
Hg Solid (CNO)2 Mantieni sott'acqua. Daniel Grohmann/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. Ottenimento
Dopo la sua scoperta c'era commercialmente attraverso le reazioni tra etanolo (Cho3Cap2OH), mercurio (HG) e acido nitrico (HNO3).
Può servirti: Clausius-Clapeyron Equation: a cosa serve, esempi, eserciziIn uno degli studi più importanti sulla struttura di questo composto, i ricercatori suggeriscono che per ottenere maggiori prestazioni durante la loro preparazione, la prima metà del volume totale di etanolo deve essere aggiunta alla miscela HG e HNO3 Prima che i gas marroni scompaiano.
In altre parole, è importante che siano presenti ossidi di azoto in modo che la reazione proceda.
Quello che succede per primo è la conversione dell'etanolo in acetaldeide. Secondo alcuni studi, seguono una maggiore ossidazione, nitrazione, decarbossilazione e eliminazione dell'acido nitroso in modo che il fulminat sia formato.
Uso come agente detonante di altri esplosivi
Applicazioni di guerra
I primi tentativi di usare il fulminato di mercurio come polvere esplosiva per le armi da fuoco furono frustrati dalla straordinaria velocità e dalla violenza della loro detonazione.
Le pistole e i fucili sono stati distrutti da piccoli carichi di questo composto. È successo anche con artiglieria e pezzi di granate in test militari.
Tuttavia, nel 1822 l'inglese Wright lo usò per la prima volta come fuoco nei suoi fucili da caccia sportivi. Successivamente in Brittany è stato implementato il suo uso nei moschetti di fanteria e poi in tutta Europa.
 Nel diciannovesimo secolo il fulminato del mercurio fu usato come detonatore di molti tipi di armi di guerra. Autore: Vetsikas Dimitris. Fonte: Pixabay.
Nel diciannovesimo secolo il fulminato del mercurio fu usato come detonatore di molti tipi di armi di guerra. Autore: Vetsikas Dimitris. Fonte: Pixabay. Fino all'inizio del 1900 fu l'unico detonatore usato per le riprese di proiettili di qualsiasi tipo, fino a quando non furono implementate altre alternative con composti più sicuri e accessibili.
Applicazioni pacifiche
Questo composto ha svolto un ruolo importante nello sviluppo di esplosivi per scopi pacifici.
Il suo ruolo nell'invenzione della dinamite di Alfred Nobel era molto significativo. Questo scienziato combinava la nitroglicerina, un potente esplosivo, con un materiale poroso, la terra di diatomee. Ma la detonazione di questa miscela è difficile con scintille o stoppini.
Nobel ha superato questa difficoltà usando cartucce Fulminat di Mercury Fulminate che erano affidabili nella loro applicazione. Questa combinazione attualmente consente il suo utilizzo nel mining, lo sfruttamento delle cava, la costruzione di tunnel e l'ingegneria civile per la costruzione di strade, le ferrovie, i porti, ecc.
Può servirti: buteno È stato ampiamente usato come detonatore di esplosioni nella costruzione mineraria e stradali. Autore: Nyamdorj. Fonte: Pixabay.
È stato ampiamente usato come detonatore di esplosioni nella costruzione mineraria e stradali. Autore: Nyamdorj. Fonte: Pixabay. Lo stesso Alfred Nobel ha sottolineato l'importanza fondamentale del fulminato di mercurio negli sviluppi ingegneristici civili che promuovevano la dinamite.
Rischi
È un composto molto instabile ed estremamente esplosivo.
 Autore: clker-free-vector-images. Fonte: Pixabay.
Autore: clker-free-vector-images. Fonte: Pixabay. Produce tossicità acuta. È tossico se viene ingerito, inalato o se viene a contatto con la pelle. Produce facilmente la dermatite da contatto. Provoca danni agli organi interni se la persona è esposta ripetutamente o prolungata.
Molto tossico per la vita acquatica e terrestre con pericolo continuo a lungo termine.
Riferimenti
- Piombo, d.R. (Editor) (2003). Manuale CRC di chimica e fisica. 85th CRC Press.
- O.S. Biblioteca nazionale di medicina. (2019). Mercurio Difulmine. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Munroe, c.E. (1912). Nota sulla produzione di Mercury Fulminate. Journal of Industrial & Engineering Chemistry 1912, 4, 2, 152-153. Recuperato dai pub.sindrome coronarica acuta.org.
- Kurzer, f. (2000). Acido fulminico nella storia della chimica organica. J Chem. Educ. 2000, 77, 7, 851. Recuperato dai pub.sindrome coronarica acuta.org.
- Beck, w. e Klapötke, t.M. (2008). Mercury Fulminate: studio DFT ONC-HG-CNO o CNO-HG-AC-A. Journal of Molecular Structure: Theochem 848 (2008) 94-97. Recuperato da ScienceDirect.com.
- Wilson, e. (2007). Mercurio Fulminato ha revocato. Archivio di notizie chimiche e ingegneristiche 2007, 85, 36, 10. Recuperato dai pub.sindrome coronarica acuta.org.
- Brown, m.E. e Swalloe, G.M. (1981). La decomposizione termica dei sali d'argento (i) e del mercurio (ii) di 5-nitrotetrazolo e di mercurio (ii) fulminato. Thermochimica Acta, 49 (1981) 333-349. Recuperato da ScienceDirect.com.
- Alderson, h.E. (1910). Alla nuova dermatosi della vocazione. Dermatite dovuta al fulminato secco di mercurio. Cal State J Med 1910 AP; 8 (4): 114. NCBI recuperato.Nlm.NIH.Gov.
- Wikimedia Foundation (2020). Mercurio (ii) Fulmina. Recuperato da.Wikipedia.org.
- « Mercurio cloruro (ii) Struttura, proprietà, ottenimento, usi
- Caratteristiche e contributi delle civiltà agricole »

