Mercurio cloruro (ii) Struttura, proprietà, ottenimento, usi

- 1771
- 492
- Zelida Gatti
Lui Mercurio cloruro (II) È un composto inorganico formato da un atomo del mercurio metallico (Hg) e due atomi di alogeno del cloro (CL). Il mercurio è nel suo stato di ossidazione +2 e nel cloro -1.
La sua formula chimica è HGCL2. È un solido cristallino leggermente volatile a temperatura ambiente. I sindacati tra i loro atomi sono più covalenti che ionici.
 Mercurio cloruro (II). Mrgreen71/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons.
Mercurio cloruro (II). Mrgreen71/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0). Fonte: Wikimedia Commons. Quando si dissolve in acqua, mantiene la sua struttura molecolare. È anche solubile in diversi solventi organici. Alla luce della luce tende a formare mercurio metallico.
In passato era usato come antisettico e per trattare alcune malattie infettive, sia nell'uomo che negli animali. Anche come insetticida per controllare i parassiti come formiche e termiti.
Tuttavia, quando viene verificata la loro alta tossicità, la maggior parte di questi usi sono stati abbandonati ed è attualmente utilizzato solo in laboratori di chimica o di analisi biochimica.
Può sfruttare in determinate condizioni. È un composto velenoso, provoca danni a umani, animali e piante. Non dovrebbe mai essere scartato nell'ambiente. È anche sospettato di essere cancerogeno.
[TOC]
Struttura
Il cloruro di mercurio è costituito da Hg nell'ossidazione II e cloro con Valencia -1. In questo haluro i collegamenti tra gli atomi hanno un carattere covalente molto marcato.
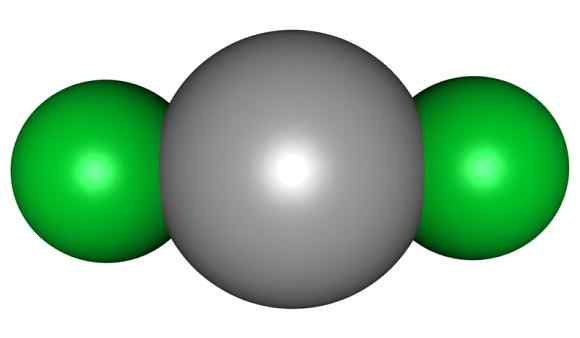 Molecola HGCL2. Grigio = mercurio; Verde = cloro. Arrowsmaster / pubblico dominio. Fonte: Wikimedia Commons.
Molecola HGCL2. Grigio = mercurio; Verde = cloro. Arrowsmaster / pubblico dominio. Fonte: Wikimedia Commons. Ciò significa che nel vetro il composto mantiene la sua struttura molecolare Cl-Hg-Cl in cui la distanza HG-CL è simile a quando è in uno stato gassoso, mentre nel vetro la distanza con gli atomi di cloro di altre molecole è molto anziano.
 Disposizione delle molecole HGCL2 Nel vetro. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons.
Disposizione delle molecole HGCL2 Nel vetro. Benjah-bmm27 / dominio pubblico. Fonte: Wikimedia Commons. In stato gassoso è chiaramente molecolare e anche in soluzione acquosa.
Nomenclatura
- Mercurio cloruro (II)
- Cloruro mercurico
- Mercurio Bicloruro
- Dicloromerio
Proprietà
Stato fisico
Solido cristallino bianco, cristalli rombici.
 Cloruro mercurico solido. LeIEM/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons.
Cloruro mercurico solido. LeIEM/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0). Fonte: Wikimedia Commons. Peso molecolare
271,5 g/mol
Punto di fusione
280 ºC
Punto di sublimazione
A 300 ° C sublima, cioè, va direttamente dal solido del gas.
Densità
5,6 g/cm3
Solubilità
Piccola acqua solubile: 7,31 g/100 ml a 25 ° C. Alcool solubile: 33 g/ 100 ml a 25 ° C. Etil acetato solubile. Piccolo solubile in etere: 4 g/100 ml. Qualcosa di solubile in benzene.
Può servirti: Helmholtz Free Energy: unità, come viene calcolato e risolto eserciziph
Una soluzione di 0,2 moli/L ha un pH di 3,2-4,7.
Proprietà chimiche
In soluzione acquosa c'è quasi esclusivamente (∼ 99%) sotto forma di una molecola HGCL2. Tuttavia, subisce un po 'di idrolisi:
Hgcl2 + H2O ⇔ hg (oh) cl + h+ + Cl-
Hgcl2 + 2 h2O ⇔ hg (oh)2 + 2 h+ + 2 Cl-,
Presenta una marcata solubilità nei solventi organici, dove assume la forma di dimeri, cioè due molecole legate.
In presenza di materia organica e per azione della luce solare è ridotto formando cloruro di mercurio (I) (HGCL) e poi mercurio metallico.
Hgcl2 + Luce solare → hgcl → hg0
Con la soluzione di idrossido di sodio (NAOH) genera un precipitato giallo precurum giallo (HGO).
È incompatibile o reagisce con forme, solfiti, fosfati, solfuri, gelatina, albumina, alcali, ammoniaca, idrossido di calcio, bromuri, carbonati, ferro, rame, piombo, sali d'argento e alcuni materiali vegetali.
Altre proprietà
A causa del suo carattere ionico più covalente del carattere ionico, è leggermente volatile a temperatura ambiente ed è in modo apprenamente volatilizzato a 100 ° C.
Ottenimento
Puoi preparare il mercurio metallico ossidante (HG0) con gas di cloro (CL2). Quando si riscaldano e si raggiungono più di 300 ° C, appare una fiamma e un vapore che viene raccolto viene sublimato e quando si formano i cristalli HGCL2.
Hg + Cl2 + Calore → hgcl2
Si ottiene anche riscaldando il solfato di mercurio (ii) asciutto con cloruro di sodio. Vapori HGCL2 Quel subliman viene raccolto e condensato a un solido cristallino.
Hgso4 + 2 NaCl → HGCL2 + N / a2SW4
La reazione tra ossido di mercurio (II) con acido cloridrico in quantità stechiometriche produce cristalli HGCl2 Quando il mezzo è raffreddato.
HGO + 2 HCl → HGCL2 + H2O
I cristalli possono essere purificati mediante ricristallizzazione e sublimazione.
Applicazioni
In laboratori chimici
È usato come reagente in varie analisi chimiche. Permette la preparazione di altri composti di mercurio, come ioduro di mercurio (II), ossido di mercurio (II), cloruro di mercurio (I), ammonio e cloruro di mercurio (II).
Può servirti: fluoro: storia, proprietà, struttura, ottenimento, rischi, usiIn laboratori di patologia
Fa parte della soluzione acetica di Zenker, che viene utilizzata per trattare campioni o campioni di biopsie del midollo osseo. I tessuti sono rapidamente impostati con eccellenti dettagli istologici da osservare con il microscopio.
 A volte HGCL2 È usato nei laboratori di patologia. Autore: Ernesto Eslava. Fonte: Pixabay.
A volte HGCL2 È usato nei laboratori di patologia. Autore: Ernesto Eslava. Fonte: Pixabay. Usi abbandonati
In epoca medievale e fino all'inizio della XX veniva utilizzato in varie applicazioni, poiché il suo effetto dannoso per la salute era sconosciuto.
- Come trattamento di alcune malattie, antisettico e disinfettante topico.
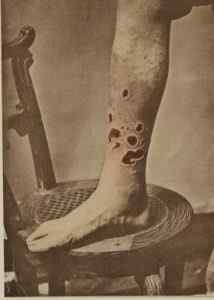 Nel passato HGCL2 È stato usato per trattare la sifilide. G. H. Volpe / dominio pubblico. Fonte: Wikimedia Commons.
Nel passato HGCL2 È stato usato per trattare la sifilide. G. H. Volpe / dominio pubblico. Fonte: Wikimedia Commons. - Nella medicina veterinaria come agente caustico, disinfettante e antisettico.
- In agricoltura ha agito da fungicida, per controllare i vermi di terra, come l'insetticida e il repellente di scarafaggi, formiche e termiti e come disinfettante per proteggere semi e bulbi.
- Per la conservazione del legno, l'agente chimico per imbalsamare e conservare campioni anatomici.
- Come catalizzatore nell'ottenere il cloruro di vinile dall'acetilene.
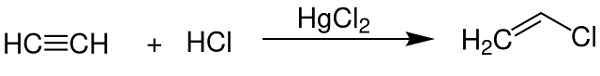 Il cloruro di mercurio (II) funge da catalizzatore per ottenere alcuni composti chimici. CHEM SIM 2001 / Public Domain. Fonte: Wikimedia Commons.
Il cloruro di mercurio (II) funge da catalizzatore per ottenere alcuni composti chimici. CHEM SIM 2001 / Public Domain. Fonte: Wikimedia Commons. - Nell'elettrodo in alluminio.
- Segnare ferro e acciaio.
- Come reagente fotografico.
- Nella stampa di tessuti, come mordente per la pelliccia di coniglio e ricino, per la tintura in legno.
- Come componente di batterie secche.
Rischi
Alla salute
È un composto corrosivo ed estremamente tossico se viene ingerito, in quanto può causare la morte. Attacca il tratto gastrointestinale e il sistema renale. Causare gravi ustioni sulla pelle e gli occhi.
L'esposizione prolungata o ripetuta a questo composto provoca danni agli organi interni. Tutte le forme di mercurio sono velenose e l'HGCL2 è uno dei più tossici.
Si sospetta che sia cancerogeno, che provoca difetti genetici e danni alla fertilità.
Pericolo di incendio
Sebbene non sia il carburante che può esplodere quando si applica il calore. Quando si rompe i gas tossici tossici e di mercurio.
Miscele HGCL2 Con metalli alcalini come sodio o potassio sono molto sensibili ai colpi e possono sfruttare con gli impatti. Se entri in contatto con ammoniaca, solfuri, acido ossalico e acetilene possono anche esplodere.
Può servirti: acido cloridrico (HCL)Effetti sull'ambiente
È molto tossico per gli organismi acquatici e terrestri, i suoi effetti durano nel tempo. Può presentare bioaccumulo in tutta la catena alimentare, sia nelle piante che negli animali.
 Il cloruro mercurico non dovrebbe mai essere scartato nell'ambiente. Autore: Naadjuuh. Fonte: Wikimedia Commons.
Il cloruro mercurico non dovrebbe mai essere scartato nell'ambiente. Autore: Naadjuuh. Fonte: Wikimedia Commons. Colpisce la respirazione, la fotosintesi e altri percorsi metabolici delle piante che causano il loro deterioramento. La sua disposizione nell'ambiente (né l'acqua né i terreni né l'atmosfera) non dovrebbero essere colpite).
Presenza pericolosa in alcuni rimedi naturali
Nonostante la sua tossicità, ci sono rimedi naturali ed erbe che lo contengono, quindi le persone, senza saperlo, sono pericolosamente esposte a questo composto.
Ad esempio, nella medicina tradizionale cinese Calomel o Qing Fen contiene un po 'di HGCL2. È un rimedio usato come diuretico, antisettico, unguento cutaneo, lassativo e applicato esternamente per il disagio della dentatura nei bambini.
 Alcuni medicinali naturali controllati dalle Nazioni Unite possono contenere HGCL2. Autore: Silvija Esseres. Fonte: Pixabay.
Alcuni medicinali naturali controllati dalle Nazioni Unite possono contenere HGCL2. Autore: Silvija Esseres. Fonte: Pixabay. Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Cloruro mercurico. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Lester, s.C. (2010). Elaborazione del campione. Zenker's Acetic Fixative (Orange). In manuale di patologia chirurgica (terza edizione). Recuperato da ScienceDirect.com.
- Clarksson, t.W. (2001). Agenti. Proprietà fisiche e chimiche. In Handbook of Peticid Toxicology (Second Edition). Recuperato da ScienceDirect.com.
- Fretham, s.J.B. et al. (2015). Mercurio e neurodegenerazione. Rimedi naturali ed erbe contenenti Hg. In nutraceutici bioattivi e integratori alimentari nelle malattie neurogiche e cerebrali. Recuperato da ScienceDirect.com.
- Cavaliere, s. et al. (2014). Distribuzione e abbondanza di piante acquatiche - impatti umani. Polutanti chimici. Nella modulazione di riferimento nei sistemi terrestri e nelle scienze dell'ambiente. Recuperato da ScienceDirect.com.
- Piombo, d.R. (Editor) (2003). Manuale CRC di chimica e fisica. 85th CRC Press.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Ciavatta, l. e Grimaldi, M. (1968). L'idrolisi del cloruro di mercurio (II), HGCL2. Journal of Inorganic and Nuclear Chemistry, Volume 30, Numero 2, febbraio 1968, pagine 563-581. Recuperato da ScienceDirect.com.
- Wikimedia Foundation (2020). Cloruro di mercurio (ii). Recuperato da.Wikipedia.org.
- « 21 scienziati messicani e i loro contributi storici
- Struttura del fulmina di mercurio, proprietà, ottenimento, usi »

