Forze intermolecolari
- 1860
- 140
- Silvano Montanari
 Schema di tipi di forze intermolecolari
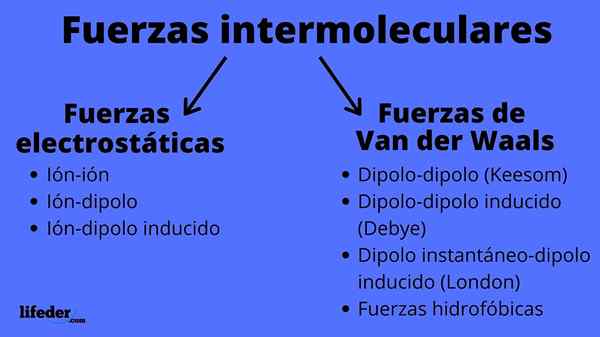
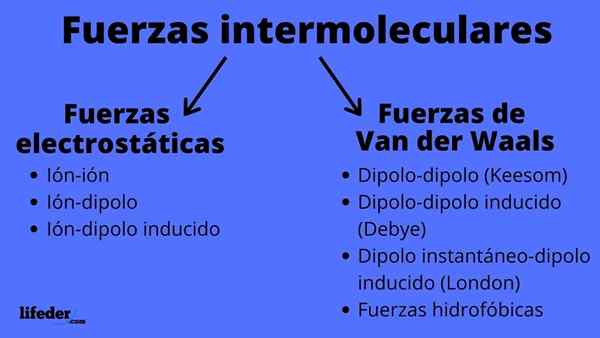
Schema di tipi di forze intermolecolari Cosa sono le forze intermolecolari?
IL Forze intermolecolari Sono un insieme di interazioni che si svolgono tra le molecole, dello stesso composto chimico o meno, e che le tengono insieme. Grazie a queste forze, le molecole riescono a raggruppare e definire un solido, liquido o gas; Cioè, sono responsabili delle proprietà fisiche delle sostanze.
Le forze intermolecolari possono essere di due tipi: Electrostatic o Van der Waals. Quelli elettrostatici sono tutti quelli in cui abbiamo ioni, che sono atomi o molecole caricate elettricamente (+ o -). Nel frattempo, quelli di van der Waals coinvolgono atomi o molecole neutri, che per fluttuazioni nella loro distribuzione elettronica sono polarizzate e attratte o respinte tra loro.
Le forze intermolecolari possono essere paragonate all'unione esistente tra diversi pezzi di laici. A seconda delle loro forme e delle linee guida, i loro sindacati diventano più deboli, così come cambiano il design e le dimensioni finali della costruzione.
Più sono più forti queste forze, più è difficile separare i pezzi di laici o, nel caso della chimica, le molecole. Ciò significa anche che ci sarà una maggiore compattazione e che, quindi, le molecole definiranno liquidi più viscosi, gas più pesanti o più densi.
Altre proprietà fisiche come fusion e punti di ebollizione, volatilità, consistenza, ecc., Sono anche riflessi macroscopici delle forze intermolecolari che governano tra le molecole o gli ioni di un composto o miscele. Ad esempio: le forze intermolecolari dei gas sono molto deboli rispetto a quelle di una pietra.
Comprendere le forze intermolecolari è essenziale per descrivere molti concetti chimici, fisici e biologici.
Forze elettrostatiche
Ione ionico
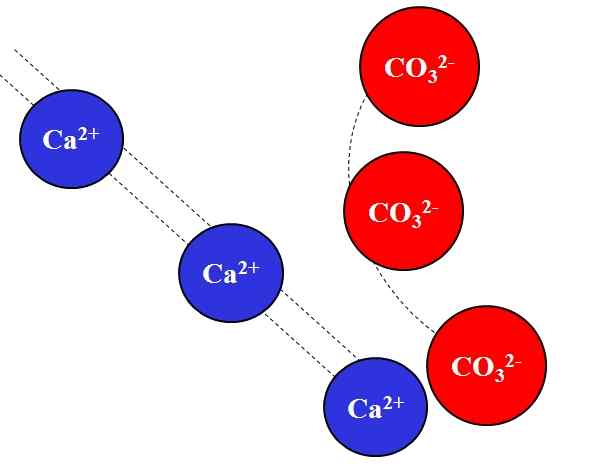 Attrazione elettrostatica tra ioni Ca2+ e CO32-. Fonte: Gabriel Bolívar.
Attrazione elettrostatica tra ioni Ca2+ e CO32-. Fonte: Gabriel Bolívar. Le cariche opposte attirano gli ioni con grande forza, che è dovuta alla legge di Coulomb e diminuisce rapidamente più gli ioni si allontanano.
Ad esempio, lo ione di Ca2+ È una carica positiva, un catione, mentre il CO32- È uno ione di carico negativo, un anione. Essendo i tuoi carichi opposti, CA2+ e co32- Si attirano l'un l'altro, evidenziando che più sono più vicini, più rimarranno insieme.
Al contrario, gli ioni con lo stesso carico, positivi o negativi, si respingono con la stessa forza ma nel senso opposto. Quindi, il CA2+ Respingendo gli ioni come Na+, Mg2+, K+, eccetera., a meno che non ci siano altri anioni che riducono la repulsione.
Può servirti: Dibenzalacetona: proprietà, meccanismo di reazione, usi, rischiDi tutte le forze intermolecolari, quelle del tipo ione ionico sono le più semplici; Ma allo stesso tempo, il più forte di tutti. Molta energia o calore è necessario per separare gli ioni.
Ion-dipolo
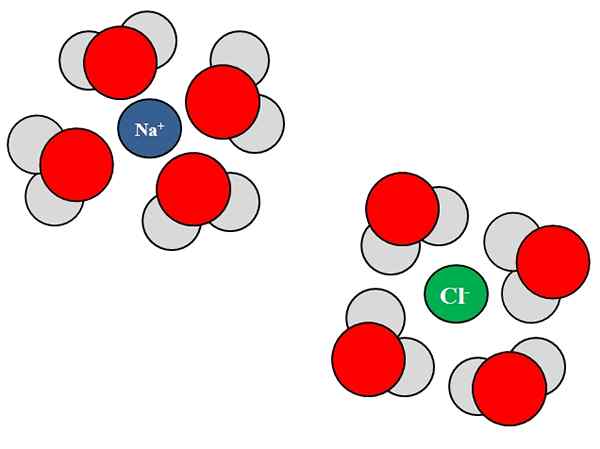 Interazioni ion-dipolo tra molecole d'acqua e ioni NaCl. Fonte: Gabriel Bolívar.
Interazioni ion-dipolo tra molecole d'acqua e ioni NaCl. Fonte: Gabriel Bolívar. Gli ioni possono anche interagire con atomi o molecole neutri, come l'acqua. Ciò è particolarmente vero quando si tratta delle molecole di un solvente, che Solvata, cioè circonda gli ioni all'interno del loro liquido.
Ad esempio, il cloruro di sodio, NaCl, è costituito da ioni Na+ e cl-. Quando i loro cristalli vengono gettati nell'acqua, le molecole d'acqua, H2O o hoh, idratare o circondare gli ioni di NaCl; Ma il modo in cui fanno varia a seconda dello ione in questione.
Quindi, vediamo nell'immagine superiore che lo ione na+ è idratato dagli atomi di ossigeno H h2O. Nel frattempo, lo ione CL- è idratato dagli atomi di idrogeno.
Perché? Perché l'acqua è una sostanza polare, il che significa che ha un dipolo: un palo con un carico parziale positivo e un altro con un carico parziale negativo.
L'atomo di ossigeno, perché è più elettronegativo, attira gli elettroni verso se stessi, individuando così gli elettroni più frequentemente attorno a quell'atomo; qualcosa che non accade allo stesso modo con gli atomi di idrogeno, meno elettronegativo. L'ossigeno, perché è più negativo, è orientato verso Na+; Mentre gli idrogeni, perché sono più positivi, sono orientati verso il CL-, Poiché le accuse opposte sono attratte.
Ion-dipolo indotto
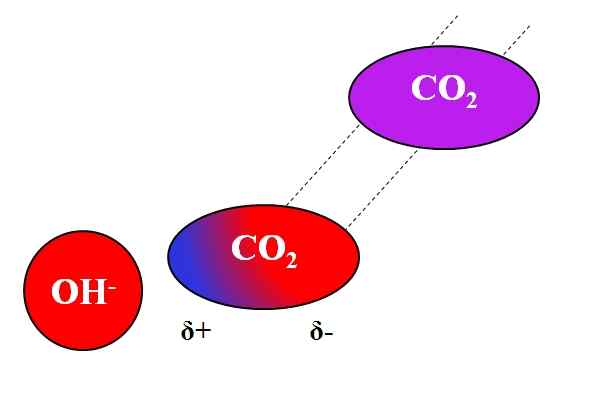 Azione induttiva oh- sulla molecola di co₂. Fonte: Gabriel Bolívar.
Azione induttiva oh- sulla molecola di co₂. Fonte: Gabriel Bolívar. Non solo le molecole polari o dipoli possono interagire con gli ioni. Per atomi o molecole neutri, anche se non hanno dipoli, la distribuzione dei loro elettroni è suscettibile agli effetti induttivi degli ioni vicini; Cioè, gli ioni causano una polarizzazione momentanea e breve, abbastanza per una notevole interazione.
Può servirti: acetato di piombo: struttura, proprietà, ottenimento, usiSupponiamo ad esempio l'interazione tra OH ion- e il co2. Il co2 È un composto neutro, la cui molecola (in viola) manca di dipolo. Tuttavia, come si avvicina OH-, Il carico negativo di questo si respinge agli elettroni degli atomi di ossigeno del CO2.
Più sono più vicini- e il co2, più forte sarà la repulsione. Di conseguenza, un dipolo indotto dall'OH inizia a essere stabilito- Informazioni su co2. Un polo positivo appare Δ+ perché gli elettroni, respinti, "emigrano" all'altra estremità della molecola.
Quindi, oh- e il co2 Rimangono abbastanza insieme per reagire tra loro. Questo è il motivo per cui co2 È particolarmente solubile nelle soluzioni alcaline.
Van der Waals forze
Le forze di van der Waals, in linea di principio, si riferiscono solo a quelle che esistono tra atomi neutri o molecole, senza carichi ionici.
Dipolo-dipolo (Keesom)
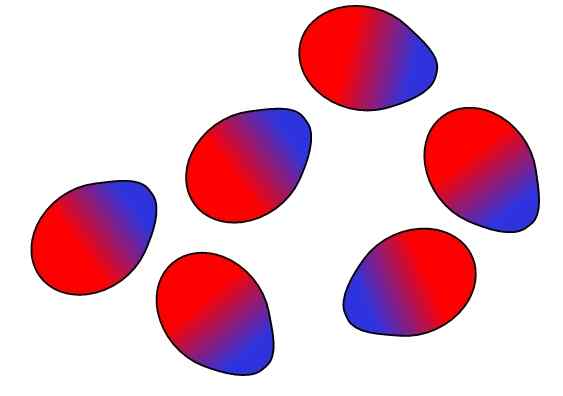 Forze dipolo-dipolo. Fonte: Gabriel Bolívar.
Forze dipolo-dipolo. Fonte: Gabriel Bolívar. Le cariche opposte sono attratte, i carichi uguali si respingono. Lo stesso vale per i dipoli: i poli opposti (Δ+ e Δ-) sono attratti, mentre i poli uguali si respingono. I poli positivi o Δ+ sono rappresentati sopra con il colore blu, tuttavia che i poli negativi o Δ- sono rappresentati con il colore rosso.
Nota come le molecole superiori sono orientate e ordinate in modo tale che i poli opposti siano, allontanandosi nel processo agli stessi poli. Questo ordinamento è ciò che è noto come interazioni o forze dipolo-dipolo (forze di keesom) e sono le più importanti forze intermolecolari tra molecole polari.
Ad esempio, molecole H2Oppure, hcl, hf, co, tra gli altri, sono ordinati in modalità simili. Più sono polari, più forti saranno le sue forze dipolo-dipolo; E quindi, più difficile sarà separare le loro molecole.
L'HF è più polare dell'HCL, quindi il punto di ebollizione dell'HF è superiore (19.5 ºC) a HCl (-85.05 ºC). È incredibile l'effetto che le forze intermolecolari hanno sulle proprietà fisiche. La variazione più piccola e la sostanza si comporterà totalmente diversa da quanto previsto.
Può servirti: stato gassoso: caratteristiche, diritto generale, esempiDipolo-Dipolo indotto (Debye)
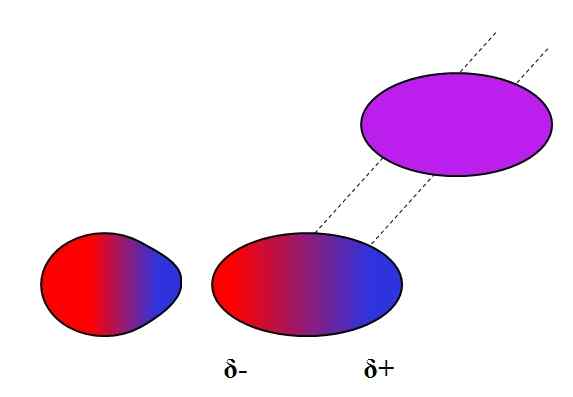 Dipolo-dipolo indotto. Fonte: Gabriel Bolívar.
Dipolo-dipolo indotto. Fonte: Gabriel Bolívar. I dipoli, come gli ioni, possono anche fluttuare o influenzare la distribuzione elettronica di atomi o molecole neutri. Così vediamo, nell'immagine superiore, che un dipolo polarizza improvvisamente una molecola neutra. Si dice quindi che si tratti di una forza di dipolo di dipolo indotta, perché il secondo dipolo è momentaneo, non permanente.
Ad esempio, l'acqua è in grado di dissolvere una piccola quantità di o2, Ma abbastanza per far respirare la fauna marina. Se h2O non potrebbe indurre un dipolo in o2, Tutto l'ossigeno dei mari sarebbe sfuggito alla superficie, perché non ci sarebbero interazioni tra le due molecole.
Dipolo indotta da dipolo (Londra)
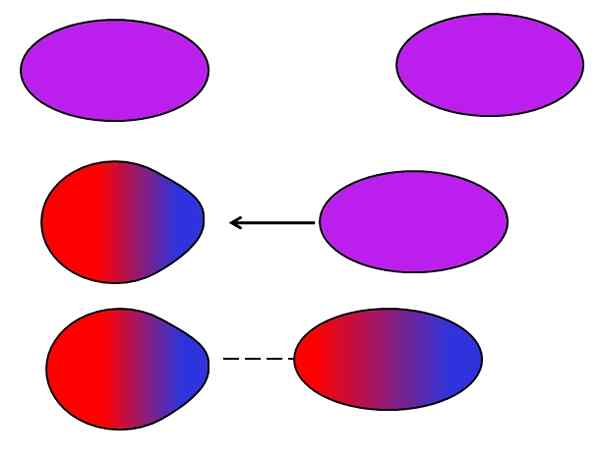 Forze di Londra. Fonte: Gabriel Bolívar.
Forze di Londra. Fonte: Gabriel Bolívar. Gli atomi o le molecole neutri non hanno bisogno di ioni o dipoli vicini per soffrire per se stessi fluttuazioni nella distribuzione dei loro carichi interni. Gli elettroni non sono ancora, ma si muovono attraverso la molecola. Ad un certo punto, avrà luogo un dipolo istantaneo, che se è molto vicino a una molecola o atomo neutro, inducerà un dipolo in essi (vedi sopra).
Più sono più grandi e asimmetriche queste molecole, più è probabile che si verifichino i dipoli istantanei. Questo è il motivo per cui i composti delle masse atomiche più alte hanno un indotto dalle forze di dipol indotte più intense. Questo tipo di forze di van der Waals è meglio conosciuta come le forze di Londra.
Ad esempio, gas nobili (lui, NE, AR, ecc.) Rimangono uniti grazie alle forze di Londra, proprio come i gas aerei (o2, N2, Co2, eccetera.). Inoltre, questa forza è la più predominante tra gli idrocarburi come il metano, Cho4, E propano, Cho3Cap2Cap3.
Forze idrofobiche
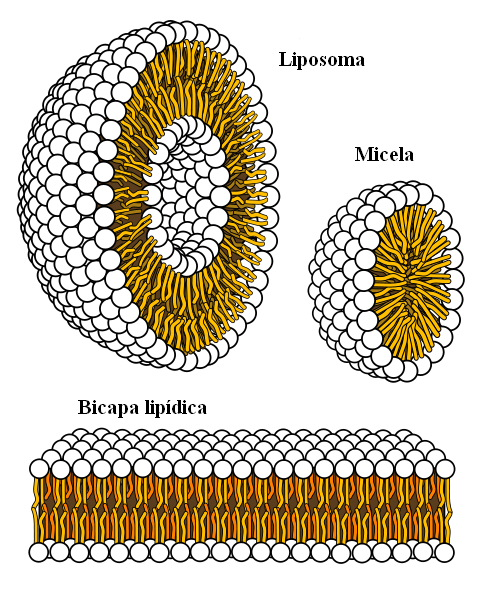 Strutture supramolecolari originate da forze idrofobiche
Strutture supramolecolari originate da forze idrofobiche Infine, abbiamo forze idrofobiche, che sono il risultato speciale delle forze e delle repulsioni di Londra tra sostanze con polarità diverse. I grassi sono poco legati all'acqua, quindi è insolubile in questo.
Le molecole di grasso cercano di raggrupparsi in modo tale che le loro interazioni con l'acqua siano il più possibile e questo riesce a formare strutture 3D come quelle sopra mostrate.
Pertanto, le molecole di grasso, come i fosfolipidi, si uniscono per formare doppi strati lipidici, micelle e liposomi.
Se osservate, queste molecole hanno una testa bianca che rappresenta una porzione polare, correlata all'acqua; così come una coda apolare, che respinge le molecole d'acqua. Le linee cercano di mettersi all'interno di queste strutture supramolecolari, in modo che non interagiscano con l'acqua.

