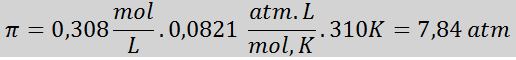Proprietà coligative di soluzioni
- 3538
- 430
- Kayla Serr
Quali sono le proprietà coligative?
IL Proprietà coligative, Chiamati anche proprietà collettive delle soluzioni, sono un gruppo di quattro proprietà che dipendono esclusivamente dalla quantità di particelle presenti nella soluzione, ma non dalla natura di queste particelle.
In altre parole, queste proprietà derivano dalla presenza di particelle diverse dal solvente, cioè particelle del soluto, ma non dipendono da chi sia il soluto. Qualsiasi tipo di particella può dare origine a proprietà coligative, non importa se si tratta di atomi, ioni o molecole. L'unica cosa che conta è la tua concentrazione.
Le proprietà coligative sono quattro:
- Decisione della pressione del vapore del solvente
- Elevazione ebullloscopica
- Discesa crioscopica
- Pressione osmotica
Tutti sono caratterizzati dall'essere proporzionali alla concentrazione del soluto nel caso di soluzioni relativamente diluite (concentrazione <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Vediamo in dettaglio ciascuna di queste quattro proprietà:
1. Decisione della pressione del vapore del solvente
Quando viene preparata una soluzione di soluto non volatile, la pressione del vapore della soluzione risultante è sempre inferiore alla pressione di vapore del solvente puro. In altre parole, dissolvere un soluto non volatile in un solvente, provoca una diminuzione della pressione di vapore di detto solvente, rispetto al solvente puro.
Formula di diminuzione della pressione del vapore
Come tutte le proprietà coligative, la diminuzione della pressione del vapore (DP) è proporzionale alla concentrazione del soluto. Combinando la legge di Raault con le equazioni della frazione molare, si può dimostrare che DP è dato da:
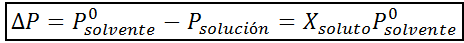
dove p °solvente rappresenta la pressione del vapore del solvente puro a una certa temperatura, psoluzione corrisponde alla pressione del vapore della soluzione e xsoluto rappresenta la concentrazione del soluto espresso come frazione molare.
Perché diminuisce la pressione del vapore con il soluto?
La forza che guida la maggior parte dei processi naturali, come l'evaporazione di un solvente, è l'aumento dell'entropia o del livello di disturbo. Quando un liquido evapora, passa da uno stato molto ordinato (nel liquido) a un molto disordinato (in gas), dal momento che nella fase gassosa c'è molta più libertà di movimento del movimento.
Può servirti: vetro violaTuttavia, in una soluzione, la presenza del soluto aggiunge disturbo alla fase liquida senza influenzare la fase gassosa (poiché il soluto non evapora).
Per questo motivo, la differenza nel livello di disturbo tra la soluzione e la fase gassosa è inferiore rispetto al solvente puro e alla fase gassosa, quindi il solvente ha meno tendenza a evaporare nel secondo caso.
Esempio
Problema: Sapendo che la pressione del vapore acqueo a una certa temperatura è di 30,55 mmHg, determinare la pressione del vapore di una soluzione preparata che si dissolve 7,20 grammi di glucosio (massa molare o mm = 180 g/mol) in 360 g di acqua (mm = 18,0 g/mol) Alla stessa temperatura.
Soluzione: In questo caso, la frazione molare del soluto deve essere calcolata prima. Abbiamo già tutti i dati necessari per questo:
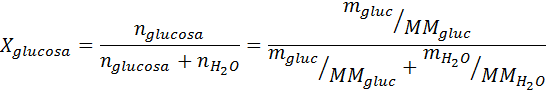
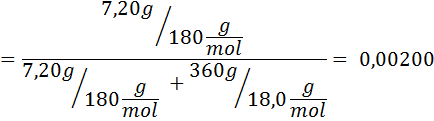
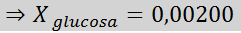
Quindi viene applicata l'equazione della pressione del vapore.
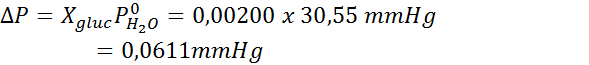
Ora determiniamo la nuova pressione a vapore del solvente:
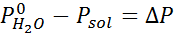
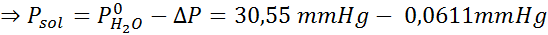
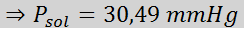
2. Elevazione ebullloscopica o punto di ebollizione
L'elevazione ebullloscopica si riferisce all'aumento del punto di ebollizione di una soluzione rispetto al punto di ebollizione del solvente puro. Per capire perché ciò accade, ricorda che il punto di ebollizione è definito come la temperatura alla quale la pressione del vapore di un liquido è eseguita pari alla pressione atmosferica.
Poiché le soluzioni hanno una pressione a vapore inferiore rispetto al solvente puro (come abbiamo appena visto nella sezione precedente), è necessario riscaldarlo più per essere in grado di raggiungere la pressione atmosferica e quindi raggiungere il suo punto di ebollizione. Per questo motivo, il punto di ebollizione delle soluzioni (con soluti non volatili) è sempre maggiore di quello del solvente puro.
Formula di elevazione ebullloscopica
L'aumento del punto di ebollizione (DTB) È proporzionale alla concentrazione del soluto espresso nella moleality, come indicato dalla seguente equazione:
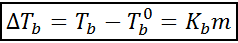
DoveB È il punto di ebollizione della soluzione, tB° È il punto di ebollizione del solvente puro, kB È la costante ebullloscopica del solvente e M È la molealità del soluto.
Esempio
Problema: Sapere che la costante di ebollizione dell'acqua è 0,52 ° C.kg/mol, determinare il punto di ebollizione della soluzione di glucosio preparata nell'esempio precedente.
Soluzione: Per determinare l'elevazione ebullloscopica abbiamo solo bisogno di moralità.
Può servirti: ossido di stagno (ii): struttura, proprietà, nomenclatura, usi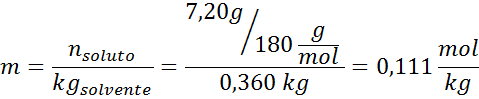
Ora applichiamo la formula DTB:
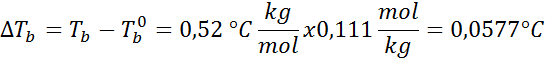
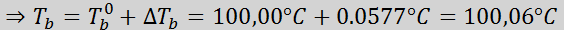
3. Discesa crioscopica
La riduzione crioscopica è la diminuzione del punto di congelamento di una soluzione rispetto al punto di congelamento del solvente puro. Il motivo per cui ciò accade è simile all'aumento ebullloscopico e ha la sua origine nella diminuzione della pressione del vapore.
Questa proprietà è ampiamente utilizzata nel freddo dove nevica in inverno. In questi paesi, è molto comune vedere camion che diffondono sali come NaCl o CACL2 sulle strade o sulle panchine pubbliche, dopo di che si scioglie la neve. Il motivo per cui si scioglie è che il sale riduce il punto di congelamento dell'acqua.
Formula di discesa crioscopica
L'equazione della discesa crioscopica è molto simile a quella dell'aumento ebullloscopico. È anche proporzionale alla concentrazione morale e dipende, in questo caso, da una costante crioscopica del solvente.
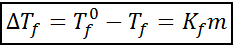
doveF È il punto di congelamento della soluzione, tF° È il punto di congelamento del solvente puro, kF È la costante crisoscopica del solvente e M È la molealità del soluto.
Esempio
Problema: Sapere che la costante di acqua crioscopica è 1,86 ° C.kg/mol, determinare il punto di congelamento della soluzione di glucosio preparata nell'esempio precedente.
Soluzione: La moralità della soluzione era già determinata, quindi possiamo determinare direttamente DTF Usando la formula precedente:
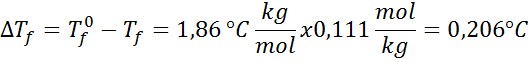
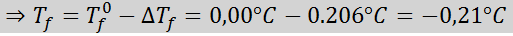
4. Pressione osmotica
L'osmosi è un processo di grande importanza a livello chimico e biologico. Ciò consiste nel flusso di molecole di solvente (ad esempio, acqua) da una soluzione diluita a un'altra soluzione più concentrata quando sono separate per mezzo di una membrana semipermeabile (che consente solo al solvente di passare, ma non al soluto).
Questa tendenza ad "assorbire" il solvente attraverso una membrana semipermeabile è una proprietà che dipende esclusivamente dalla concentrazione totale di particelle di soluto presenti nella soluzione, indipendentemente da quale sia il soluto. Per questo motivo, questa tendenza è una proprietà coligativa e viene misurata attraverso la pressione osmotica.
La pressione osmotica (π) è la pressione che dovrebbe essere applicata a una soluzione per fermare l'osmosi. Maggiore è la pressione osmotica, maggiore è la soluzione per assorbire il solvente (o, più precisamente, più tendenza si diffonde il solvente verso quella soluzione) ha la soluzione).
Può servirti: magnesio: storia, struttura, proprietà, reazioni, usiPerché si verifica l'osmosi?
La spiegazione dietro il processo di osmosi è molto semplice. Tutte le sostanze tendono a diffondersi da dove sono più concentrate dove sono più diluite. Questo è detto di seguire il tuo gradiente di concentrazione.
Quando una soluzione è più concentrata nel soluto, allo stesso tempo è più diluita nel solvente e viceversa. Per questo motivo, il solvente ha una naturale tendenza a passare dalla soluzione più diluita (in cui il solvente è più concentrato) verso la soluzione più concentrata (dove è più diluito).
Formula di pressione osmotica
La pressione osmotica può essere calcolata con una formula molto simile all'equazione dei gas ideali:
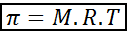
In questa equazione, π è la pressione osmotica, M è la concentrazione molare del soluto, R è la costante universale dei gas ideali (0,0821 atm.L/mol.K) e t è la temperatura assoluta in k.
Pressione osmotica e tonicità
La pressione osmotica è molto importante per il funzionamento del corpo umano. In effetti, le soluzioni saline che vengono iniettate per via endovenosa sono classificate in base al fatto che la loro pressione osmotica sia maggiore, uguale o inferiore a quella del plasma sanguigno a quella che viene chiamata tonicità.
- Una soluzione meno concentrata che il plasma ha una pressione osmotica inferiore e viene detto Soluzione ipotonica.
- Se hai la stessa concentrazione totale di soluti, viene raccontato soluzione isotonica.
- Se hai una pressione osmotica (o concentrazione) maggiore, viene detto soluzione ipertonica.
Esempio
Problema: Calcola la pressione osmotica a 310 K di una soluzione salina allo 0,9% (m/v), che è isotonica con plasma sanguigno.
Soluzione: Abbiamo già la temperatura, quindi l'unica cosa che manca è determinare la concentrazione molare delle particelle di sale (NaCl) nella soluzione. Per questo.
Ogni 100 ml di soluzione contiene 0,9 g di NaCl, quindi:
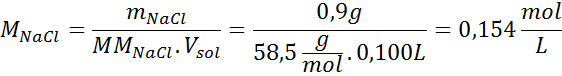
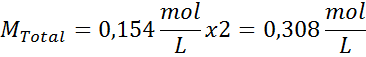
Questa è la concentrazione totale di particelle di soluto nella soluzione, quindi ora possiamo calcolare la pressione osmotica: