Unità forza ionica, come calcolarla, esempi

- 2014
- 511
- Baldassarre Ross
IL forza ionica È un modo per esprimere la concentrazione di ioni in una soluzione. Questo concetto è stato introdotto nel 1922 da Lewis e Randall mentre lavorava alla descrizione del coefficiente di attività chimica.
Quando la concentrazione degli ioni in una soluzione è alta, viene prodotta un'interazione elettrostatica tra gli ioni opposti; Cioè, i cationi e gli anioni sono molto attratti, il che si traduce in una concentrazione ionica efficace o reale è inferiore a quella calcolata per una particolare reazione chimica.
 La forza ionica dell'acqua di mare è alta, circa 0.7, a causa della sua grande concentrazione di sali disciolti
La forza ionica dell'acqua di mare è alta, circa 0.7, a causa della sua grande concentrazione di sali disciolti Per questo motivo, il concetto di attività chimica è stato introdotto come l'effettiva concentrazione ionica di una soluzione, essendo l'attività chimica il prodotto della molarità della soluzione da parte del coefficiente di attività chimica.
Questo coefficiente ha un valore vicino all'unità (1) per soluzioni ioniche diluite e per le soluzioni ideali così chiamate. Queste sono soluzioni in cui l'interazione intermolecolare tra molecole simili è uguale a quella esistente tra molecole diverse.
La creazione del concetto di forza ionica ha contribuito alla spiegazione delle deviazioni dal comportamento ideale, osservata in soluzioni ioniche reali.
[TOC]
Unità di forza ionica
La forza ionica ha come unità moli/L (molarità) o moli/kg di acqua (molealità). Quest'ultimo è raccomandato in soluzioni non ideali, che sono caratterizzate perché i volumi delle loro miscele non sono totalmente additivi.
Ciò significa, ad esempio, quanto segue: Se misto 0.5 litri di un liquido A e 0.5 litri di un liquido B, il volume risultante di questa miscela, non sarà necessariamente uguale a 1 litro, ma può essere diverso.
La forza ionica è rappresentata dal simbolo i.
Può servirti: bulanal: struttura, proprietà, usi e rischiCome calcolare la forza ionica?
Per il calcolo della forza ionica di una soluzione, sono prese in considerazione la concentrazione di tutti gli ioni presenti nella soluzione, così come le rispettive valenze.
Il valore della forza ionica si ottiene applicando la seguente formula:
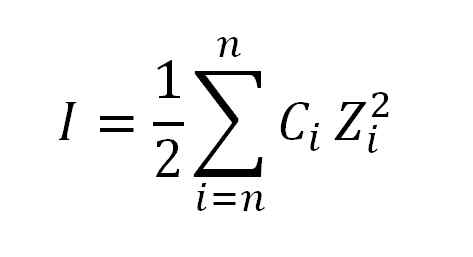 Formula usata per calcolare la forza ionica. Fonte: Gabriel Bolívar.
Formula usata per calcolare la forza ionica. Fonte: Gabriel Bolívar. Dove ho già detto, è la forza ionica; C, corrisponde alla concentrazione morale ionica o morale; Mentre z, rappresenta le rispettive valenze (± 1, ± 2, ± 3, ecc.).
L'espressione che appare nella formula nel calcolo della forza ionica (σ) viene letta come riassunto, cioè la somma del prodotto della concentrazione molare (c) di ciascun ione presente nella soluzione dal suo Valencia (Z) alto quadrata.
Come si può vedere, la valenza dello ione ha il peso maggiore nel valore della forza ionica della soluzione. Ad esempio: Valencia (z) di Ca è +2, quindi z2 È lo stesso 4. Nel frattempo, Valencia (Z) di Na es +1, e quindi, Z2 È lo stesso 1.
Ciò sottolinea che il contributo dello ione Ca2+ Per il valore della forza ionica, alla stessa concentrazione ionica molare, è quattro volte maggiore di quello dello ione Na+.
Importanza della forza ionica
La forza ionica è una misura adeguata della concentrazione ionica di una soluzione ed è la base per stabilire la teoria di Debye-Hückel. Questa teoria descrive il comportamento ideale delle soluzioni ioniche.
La forza ionica funge da base per il calcolo del coefficiente di attività (γYo), parametro che a sua volta consente il calcolo dell'attività chimica di un composto ionico, l'attività chimica è la concentrazione effettiva e reale di un composto ionico in soluzione.
Può servirti: acetato in alluminio (al (ch3coo) 3): struttura, proprietà, usiAumentando la forza ionica di una soluzione, l'interazione tra ioni aumenta. Pertanto, diminuire γYo e l'attività chimica degli ioni.
Un aumento della forza ionica può ridurre la solubilità proteica in un ambiente acquoso, questa proprietà utilizzata per la precipitazione proteica è selettivamente. Le soluzioni di solfato di forza ionica ad alta forza vengono utilizzate per le precipitazioni e la purificazione delle proteine plasmatiche.
Esempi di forze ioniche
Esempio 1
Calcola la forza ionica di una soluzione di cloruro di potassio (KCL) 0.3 m.
KCL si dissocia nel modo seguente:
KCl → K+ + Cl-
Abbiamo due ioni: il k cation+ (Z =+1) e l'anione Cl- (Z = -1). Quindi applichiamo la formula per calcolare la forza ionica i:
I = 1/2 [c · (+1)1 + C · (-1)1"
= 1/2 [0.3 m · 11 + 0.3 m · 11"
= 0.3 m
Si noti che il Valencia -1 del CL- È stato preso come 1, il suo valore assoluto, poiché altrimenti la forza ionica sarebbe uguale a 0.
Esempio 2
Calcola la forza ionica di una soluzione di solfato di calcio (caso4) 0.5m
Il caso4 Si dissocia come segue:
Caso4 → Ca2+ + SW42-
Abbiamo due ioni: il cation2+ (Z =+2) e l'anione SO42- (Z = -2). Quindi applichiamo la formula per calcolare la forza ionica i:
I = 1/2 [C · (+2)2 + C · (-2)2"
= 1/2 [0,5 m · 4 +0,5 m · 4]
= 2 m
Esempio 3
Calcola la forza ionica di un ammortizzatore con le concentrazioni finali di fosfato di sodio dibasico (NA2HPO4) 0.3 m e fosfato di sodio monobasico (NAH2Po4) 0.4 m.
Poi un2HPO4 Si dissocia come segue:
Può servirti: acido arsenico (H3SO4): proprietà, rischi e usiN / a2HPO4 → 2nd+ + HPO42-
Mentre il nah2Po4 Si dissocia segue il seguente modello:
Nah2Po4 → Na+ + H2Po4-
Procediamo come esercizi precedenti, questa volta avendo gli anioni HPO42- (Z = -2) e h2Po4- (Z = -1):
I = 1/2 [C · 2 · (+1)1 + C · (-2)2] +[C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 2 · 1 +0.3 m · 4] +[0.4 m · 1 +0.4 m · 1]
= 1/2 [0.6 m +1.2 m] +[0.4 m +0.4 m]
= 1.3 m
Si noti che la concentrazione di NA+ dal na2HPO4 È moltiplicato per 2, poiché la sua concentrazione è doppia. Tuttavia, per l'altro sale, nah2Po4, La concentrazione di Na+ Sì, lo moltiplichiamo per 1, secondo la stechiometria della sua equazione di dissoluzione.
Esempio 4
Calcola la forza ionica di una soluzione di cloruro di sodio (NaCl) 0.15 m e glucosio (c6H12O6) 0.3 m.
NaCl si dissocia come segue:
NaCl → Na+ + Cl-
Il glucosio, tuttavia, non è dissociata sugli ioni perché ha solo legami di tipo covalente nella sua struttura chimica. Pertanto, la Valencia de la Glucosa (Z) è uguale a zero (0). Calcoliamo quindi il prodotto della forza ionica di NaCl:
I = 1/2 [c · (+1)1 + C · (-1)1"
= 1/2 [0.15 m · 1 +0.15 m · 1]
= 0.15 m
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Wikipedia. (2020). Forza di ione. Recuperato da: in.Wikipedia.O
- Dottore. David k. Ryan. (S.F.). Attività e forza ionica Classe 4 Ryan. [PDF]. Recuperato da: faccia a faccia.UML.Edu
- Università del Michigan. (S.F.). Uno sguardo più dettagliato sull'equilibrio chimico. [PDF]. Recuperato da: Umich.Edu
- Elsevier b.V. (2020). Forza di ione. Scienceirect. Estratto da: ScienceDirect.com
- C.D. Kennedy. (1990). Spensio ionico e lavatura degli acidi. [PDF]. Recuperato da: IUBMB.Biblioteca online.Wiley.com

