Forza di coesione
- 4082
- 696
- Baldassarre Ross
Cosa sono le forze di coesione?
IL forze di coesione Sono le forze di attrazione intermolecolare che mantengono alcune molecole con altre. A seconda dell'intensità delle forze di coesione, una sostanza è in stato solido, liquido o gassoso. Il valore delle forze di coesione è una proprietà intrinseca di ciascuna sostanza.
Questa proprietà è correlata alla forma e alla struttura delle molecole di ciascuna sostanza. Una caratteristica importante delle forze di coesione è che diminuiscono rapidamente quando la distanza aumenta. Quindi, sono chiamate forze di coesione alle forze di attrazione che si verificano tra le molecole della stessa sostanza.
IL Forze di repulsione Sono quelli che derivano dall'energia cinetica (energia dovuta al movimento) delle particelle. Questa energia fa sì che le molecole siano costantemente in movimento. L'intensità di questo movimento è direttamente proporzionale alla temperatura alla quale è la sostanza.
Per causare il cambiamento dello stato di una sostanza è necessario aumentare la sua temperatura mediante trasmissione di calore. Ciò provoca l'aumento delle forze di repulsione della sostanza, che, se applicabile, può finire per assumere il cambiamento di stato.
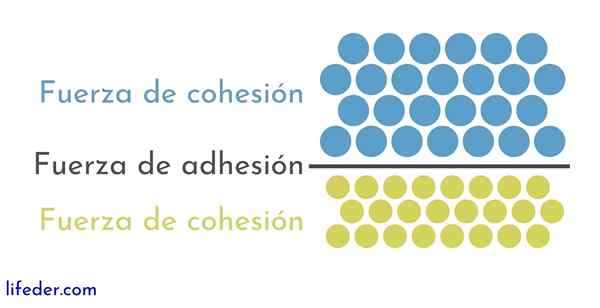
D'altra parte, è importante e necessario distinguere tra coesione e adesione:
- La coesione è dovuta alle forze di attrazione tra particelle adiacenti della stessa sostanza.
- L'adesione è il risultato dell'interazione che si verifica tra superfici di diverse sostanze o corpi.
Queste due forze appaiono correlate a diversi fenomeni fisici che colpiscono i liquidi, quindi è importante una buona comprensione sia dell'una che dell'altra.
Può servirti: Vy Canis Majoris: Discovery, Caratteristiche, Struttura, Formazione ed EvoluzioneForze di coesione in solidi, liquidi e gas
 Atomi nei tre principali stati della materia
Atomi nei tre principali stati della materia Nei solidi
In generale, nei solidi le forze di coesione sono molto elevate e vengono somministrate intensamente nelle tre direzioni dello spazio.
In questo modo, se una forza esterna viene applicata a un corpo solido, si verificano piccoli spostamenti delle molecole.
Inoltre, quando la forza esterna scompare, le forze di coesione sono abbastanza forti da tornare alle molecole nella loro posizione originale, recuperando la posizione prima dell'applicazione della forza.
In liquidi
Al contrario, nei liquidi le forze di coesione sono elevate solo in due delle direzioni spaziali, mentre sono molto deboli tra gli strati fluidi.
Pertanto, quando una forza viene applicata in una direzione tangenziale su un liquido, questa forza rompe i legami deboli tra gli strati. Questo fa scivolare gli strati liquidi sull'altro.
Quindi, quando si conclude l'applicazione della forza, le forze di coesione non hanno abbastanza forza per posizionare le molecole liquide nella sua posizione originale.
Inoltre, nei liquidi, la coesione si riflette anche nella tensione superficiale, causata da una forza sbilanciata diretta verso l'interno del liquido, agendo sulle molecole di superficie.
Allo stesso modo, si osserva anche la coesione quando viene data la transizione dallo stato liquido allo stato solido, a causa dell'effetto della compressione delle molecole liquide.
Nei gas
Nei gas, le forze di coesione sono spregevoli. In questo modo, le molecole di gassa sono in costante movimento, poiché nel loro caso le forze di coesione non sono in grado di mantenerle collegate tra loro.
Può servirti: vantaggio meccanico: formula, equazioni, calcolo ed esempiPertanto, nei gas le forze di coesione possono essere viste solo quando si verifica il processo di liquefazione, che si svolge quando le molecole gassose sono compresse e le forze di attrazione sono abbastanza forti da produrre la transizione dello stato gassoso allo stato liquido.
Esempi di forze di coesione
Spesso le forze di coesione sono combinate con le forze di adesione per dare origine a determinati fenomeni fisici e chimici.
Ad esempio, le forze di coesione insieme a quelle dell'adesione consentono di spiegare alcuni dei fenomeni più comuni che si verificano nei liquidi; Questo è il caso del menisco, della tensione superficiale e della capillarità.
Pertanto, nel caso dei liquidi è necessario distinguere tra le forze di coesione, che si verificano tra le molecole dello stesso liquido; e quelli dell'adesione, che si verificano tra le molecole del liquido e del solido.
Tensione superficiale

La tensione superficiale è la forza che si verifica tangenzialmente e per unità di lunghezza sul bordo della superficie libera di un liquido che è in equilibrio. Questo forza contrae la superficie liquida.
In definitiva, si verifica la tensione superficiale perché le forze che si verificano nelle molecole liquide sono diverse sulla superficie del liquido rispetto a quelle che si verificano all'interno.
Menisco
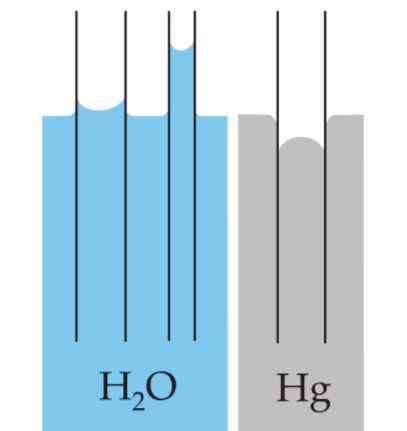
La curvatura creata sulla superficie dei liquidi è chiamata menisco quando confinata in un contenitore. Questa curva è prodotta dall'effetto che la superficie del contenitore ha sul liquido che la contiene.
Può servirti: misuratori di pressioneLa curva può essere convessa o concava, a seconda che la forza tra le molecole del liquido e quelle del contenitore siano di attrazione - come nel caso dell'acqua e del vetro - o siano di repulsione, come nel caso di mercurio e vetro.
Capillarità
 Esempio di capillarità
Esempio di capillarità La capillarità è una proprietà di fluidi che consente loro di salire o scendere attraverso un tubo capillare. È la proprietà che consente, in parte, l'ascesa dell'acqua all'interno delle piante.
Un liquido sale attraverso il tubo capillare quando le forze di coesione sono inferiori a quelle dell'adesione tra il liquido e le pareti del tubo. In questo modo, il liquido continuerà ad aumentare fino a quando il valore della tensione superficiale è uguale al peso del liquido contenuto nel tubo capillare.
Al contrario, se le forze di coesione sono più alte di quelle dell'adesione, la tensione superficiale scenderà al liquido e la forma della sua superficie sarà convessa.
Riferimenti
- Coesione (chimica) (n.D.). In Wikipedia. Recuperato da.Wikipedia.org.
- Tensione superficiale (n.D.). In Wikipedia. Recuperato da.Wikipedia.org.
- Capillarità (n.D.). In Wikipedia. Recuperato da ES.Wikipedia.org.
- Iran. Levine; Volume 1 "fisica"; Quinta edizione; 2004; Mc Graw Hillm.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2005). Chimica: la scienza molecolare. Belmont, CA: Brooks/Cole.
- Bianco, Harvey e. (1948). Fisica universitaria moderna. Van Nostrand.


