Struttura, Proprietà, Usi, Rischi, Rischi, Rischi, Rischi, Rischi di alluminio (AIP)

- 3155
- 958
- Cosetta Messina
Lui fosfuro di alluminio È un composto inorganico formato da un atomo di alluminio (AL) e un atomo di fosforo (P). La sua formula chimica l'ALP. È un solido grigio scuro o, se è molto puro, giallo. È un composto estremamente tossico per gli esseri viventi.
Il fosfuro di alluminio reagisce con l'umidità per formare fosfina o pH fosfano3, che è un gas velenoso. Per questo motivo, l'ALP non dovrebbe contattare l'acqua. Reagisce fortemente con acidi alcalini e soluzioni.
 Fosfuro di alluminio. همان [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons.
Fosfuro di alluminio. همان [gfdl (http: // www.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons. È stato usato in passato per eliminare i parassiti come insetti e roditori in luoghi in cui sono stati immagazzinati cereali e altri prodotti agricoli. Tuttavia, a causa del suo alto pericolo è stato proibito nella maggior parte dei paesi del mondo.
Attualmente, la sua utilità nell'area elettronica è teoricamente studiata attraverso computer che calcolano la possibilità di ottenere nanotubi di alp a semiconduttore, ovvero tubi estremamente piccoli che possono trasmettere elettricità solo in determinate condizioni.
Il fosfuro di alluminio è un composto molto pericoloso, deve essere manipolato con strumenti di sicurezza come guanti, lenti, attrezzature per la respirazione e abbigliamento protettivo.
[TOC]
Struttura
Il fosfuro di alluminio ALP è formato dall'unione di un atomo di alluminio sull'atomo di fosforo p. Il legame tra i due è covalente e triplo, quindi è molto forte.
L'alluminio nell'ALP ha uno stato di ossidazione di +3 e il fosforo ha una valenza di -3.
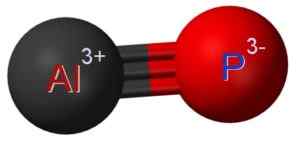 Struttura di fosfuro in alluminio in cui è possibile vedere il triplo legame tra atomi di alluminio (AL) e fosforo (P) (P). Claudio Pistilli [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Struttura di fosfuro in alluminio in cui è possibile vedere il triplo legame tra atomi di alluminio (AL) e fosforo (P) (P). Claudio Pistilli [CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. Nomenclatura
- Fosfuro di alluminio
Proprietà
Stato fisico
Solido cristallino grigio scuro o giallo scuro. Cristalli cubici.
Peso molecolare
57.9553 g/mol
Punto di fusione
2550 ºC
Densità
2,40 g/cm3 a 25 ° C
Solubilità
Si decompone in acqua.
Proprietà chimiche
Reagisce con l'umidità per dare fosfina o pH fosfano3 che è un composto infiammabile e velenoso. Fosfina o fosfaano.
Può servirti: gadolinio: struttura, proprietà, ottenimento, usiLa reazione di fosfuro in alluminio con l'acqua è la seguente:
Fosfuro di alluminio + acqua → idrossido di alluminio + fosfina
ALP + 3 h2O → a (oh)3 + Ph3↑
Le presentazioni commerciali hanno carbonato di alluminio al2(CO3)3 per prevenire l'auto -direzione della fosfina che si verifica quando l'ALP entra in contatto con l'umidità dell'aria.
ALP è stabile quando è asciutto. Reagisce violentemente con acidi alcalini e soluzioni.
L'ALP in alluminio fosfuro non si scioglie, né sublimale o si decompone termicamente a temperature fino a 1000 ° C. Anche a questa temperatura la sua pressione del vapore è molto bassa, cioè non evapora a quella temperatura.
Quando riscaldato alla sua decomposizione emette ossidi di fosforo tossici. In contatto con i metalli puoi emettere gas idrogeno infiammabile h2.
Altre proprietà
Quando è puro mostra una colorazione giallastra, quando viene mescolata con resti della reazione di preparazione presenta il colore dal grigio al nero.
La sua bassa volatilità esclude che ha un odore, quindi l'odore dell'aglio che a volte emette è dovuto al pH della fosfina3 che si forma in presenza di umidità.
Ottenimento
Il fosfuro in alluminio può essere ottenuto riscaldando una miscela di polvere di metallo in alluminio (Al) e l'elemento di fosforo rosso (P).
A causa dell'affinità del fosforo (P) da parte dell'ossigeno (o2) e quello dell'alluminio (al) da ossigeno e azoto (n2), La reazione deve essere eseguita in atmosfera libera di questi gas, come l'atmosfera di idrogeno (H2) o gas naturale.
La reazione inizia a riscaldare rapidamente un'area della miscela fino all'inizio della reazione, che è esotermica (il calore si verifica durante lo stesso). Da quel momento in poi, la reazione procede rapidamente.
Alluminio + fosforo → fosfuro di alluminio
4 a + p4 → 4 ALP
Applicazioni
Nell'eliminazione dei parassiti (uso interrotto)
Il fosfuro di alluminio è stato usato in passato come insetticida e come sterminatore di roditori. Tuttavia, sebbene sia stato proibito dalla sua tossicità, è ancora usato in alcune parti del mondo.
Può servirti: .Acido stearico (CH3 (CH2) 16COOH): struttura, proprietà, usiViene utilizzato per la fumigazione in spazi chiusi in cui si trovano prodotti alimentari trasformati o non trasformati (come i cereali), alimenti per prodotti animali e non alimentari.
L'obiettivo è controllare gli insetti e i roditori che attaccano articoli immagazzinati, commestibili o no.
Consente di controllare i roditori e gli insetti in aree non adomestiche, agricole o non agricole, fumigando all'aperto o nelle loro tane e nidi per impedire a determinate malattie di trasmettere.
 Ratti e topi sono parassiti che attaccano i posti di cereali. Alcuni anni fa sono stati combattuti con fosfuro di alluminio. Autore: Andreas n. Fonte: Pixabay.
Ratti e topi sono parassiti che attaccano i posti di cereali. Alcuni anni fa sono stati combattuti con fosfuro di alluminio. Autore: Andreas n. Fonte: Pixabay.  I roditori sono stati controllati posizionando il fosfuro di alluminio nelle loro tane. Autore: foto-rabe. Fonte: Pixabay.
I roditori sono stati controllati posizionando il fosfuro di alluminio nelle loro tane. Autore: foto-rabe. Fonte: Pixabay. La sua forma di utilizzo consiste nell'esposizione dell'ALP nell'aria o nell'umidità, poiché viene rilasciata la fosfina o il pH fosfaano3 che genera danni a molti organi di peste per eliminare.
 Gli insetti sono stati inoltre eliminati con Alp Aluminio fosfuro. Autore: Michael Power. Fonte: Unspash.
Gli insetti sono stati inoltre eliminati con Alp Aluminio fosfuro. Autore: Michael Power. Fonte: Unspash. In altre applicazioni
Il fosfuro di alluminio ALP è usato come fonte di fosfina o pH fosfano3 e viene utilizzato nella ricerca sui semiconduttori.
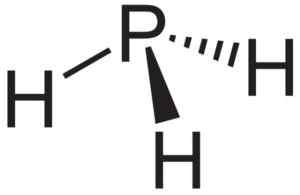 Fosfaano o fosfina pH3, composto che si forma quando il fosfuro di alluminio ALP viene a contatto con l'acqua. Neuroteker [dominio pubblico]. Fonte: Wikimedia Commons.
Fosfaano o fosfina pH3, composto che si forma quando il fosfuro di alluminio ALP viene a contatto con l'acqua. Neuroteker [dominio pubblico]. Fonte: Wikimedia Commons. Ricerca teorica dei nanotubi ALP
Sono stati condotti studi teorici sulla formazione di nanotubi di fosfuro in alluminio ALP. I nanotubi sono cilindri molto piccoli e molto sottili che possono essere visibili solo con un microscopio elettronico.
Nanotubi ALP con boro
Gli studi teorici condotti attraverso calcoli computazionali mostrano che le impurità che potrebbero essere aggiunte ai nanotubi di ALP potrebbero cambiare le proprietà teoriche di questi.
Ad esempio, si stima che l'aggiunta di atomi di boro (b) ai nanotubi di ALP possa trasformarli in semiconduttori di tipo-P. Un semiconduttore è un materiale che si comporta come un conduttore di elettricità o come un isolamento a seconda del campo elettrico a cui è sottoposto.
Può servirti: stato al plasma: caratteristiche, tipi ed esempiE un tipo semiconduttore-P È quando il materiale viene aggiunto impurità, in questo caso l'ALP è il materiale di partenza e gli atomi di boro sarebbero impurità. I semiconduttori sono utili per le applicazioni elettroniche.
Nanotubi ALP con struttura alterata
Alcuni scienziati hanno effettuato calcoli per determinare l'effetto di cambiare la struttura della rete cristallina dei nanotubi di ALP da esagonale a ottaedrico.
Hanno scoperto che la manipolazione della struttura della rete cristallina potrebbe essere utilizzata per regolare la conduttività e la reattività dei nanotubi di ALP e progettarli in modo che siano utili per l'elettronica e le applicazioni ottiche.
Rischi
Il contatto con il fosfuro di alluminio può irritare la pelle, gli occhi e le mucose. Se viene ingerito o inalato è tossico. Può essere assorbito attraverso la pelle con effetti tossici.
Se l'ALP entra in contatto con l'acqua reagisce e la forma di fosfina o pH fosfano3 che è estremamente infiammabile perché brucia a contatto con l'aria. Pertanto può sfruttare. Inoltre la fosfina provoca la morte di umani e animali.
Poiché un pesticida economico è il fosfuro in alluminio, il suo uso è una causa comune dell'avvelenamento da parte delle persone e comporta un alto tasso di mortalità.
 Il fosfuro di alluminio è estremamente pericoloso. Autore: vettori di OpenClipart. Fonte: Pixabay.
Il fosfuro di alluminio è estremamente pericoloso. Autore: vettori di OpenClipart. Fonte: Pixabay. Reagisce con l'umidità delle mucose e con l'acido cloridrico HCl dello stomaco che forma il gas PH di fosfano molto tossico3. Pertanto, per inalazione e ingestione, la fosfina si forma all'interno del corpo, con effetti fatali.
La sua ingestione provoca emorragia del tratto gastrointestinale, collasso cardiovascolare, disturbi neuropsichiatrici, insufficienza respiratoria e renale in poche ore.
L'ALP è molto tossico per tutti gli animali terrestri e acquatici.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Fosfuro in alluminio. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Sjögren, b. et al. (2007). Alluminio. Altri composti in alluminio. Nel manuale sulla tossicologia dei metalli (terza edizione). Recuperato da ScienceDirect.com.
- Gupta, r.C. e Crissman, J.W. (2013). Valutazione della sicurezza compresi i problemi attuali ed emergenti nella patologia tossicologica. Rischio umano. Nel manuale di tossicologia di Haschek e Rousseaux (terza edizione). Recuperato da ScienceDirect.com.
- Bianco, w.E. e Bushey, a.H. (1944). Fhosfuro di alluminio - preparazione e composizione. Journal of the American Chemical Society 1944, 66, 10, 1666-1672. Recuperato dai pub.sindrome coronarica acuta.org.
- Mirzaei, Maryam e Mirzaei, Mahmoud. (2011). Uno studio teorico dei nanotubi di fosfuro in alluminio boro-due. Chimica computazionale e teorica 963 (2011) 294-297. Recuperato da ScienceDirect.com.
- Takahashi, l. E Takahashi, K. (2018). Sintonizzazione della struttura elettronica di un nanotubo fosfuro in alluminio questo. ACS Appl. Nano mater. 2018, 1, 501-504. Recuperato dai pub.sindrome coronarica acuta.org.
- Gupta, p.K. (2016). Effetti tossici dei pesicidi (agrochimici). Fosfuro in alluminio. In fondi di tossicologia. Recuperato da ScienceDirect.com.
- « Coordinate rettangolari Esempi ed esercizi risolti
- Grado di un polinomio come viene determinato, esempi ed esercizi »

