Struttura del fattore di necrosi tumorale (TNF), meccanismo d'azione, funzione
- 4911
- 1133
- Silvano Montanari
Lui Fattore di necrosi tumorale (TNF), noto anche come caquectina, è una proteina prodotta naturalmente nelle cellule fagocitiche o macrofagi del corpo umano e altri animali di mammifero. È un citoquino molto importante che partecipa sia a normali processi fisiologici che alla diversità dei processi patologici corporei.
La sua scoperta risale a poco più di 100 anni fa, quando W. Coley ha usato estratti batterici grezzi per trattare i tumori in diversi pazienti e ha scoperto che questi estratti avevano la capacità di indurre la necrosi di questi tumori, innescando al contempo una reazione infiammatoria sistemica nei pazienti in pazienti.
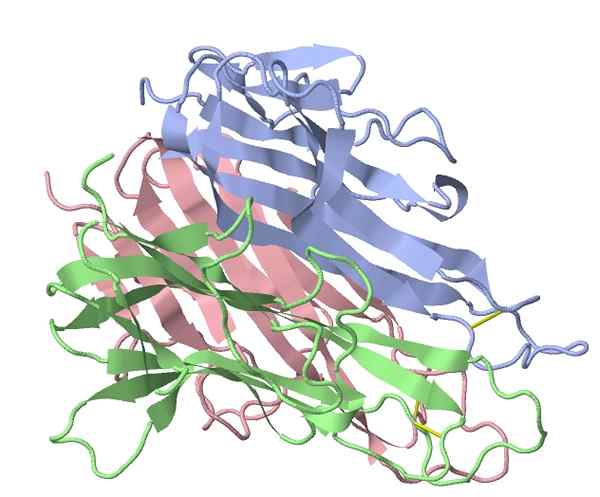
 Fattore di topo alfa necrosi tumorale (fonte: TK Vallery/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons)
Fattore di topo alfa necrosi tumorale (fonte: TK Vallery/CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/3.0) via Wikimedia Commons) Il principale stimolatore "pro-infiammatorio" attivato dagli estratti batterici utilizzati da Coley è stato identificato nel 1975, dimostrando che un fattore proteico nel siero dei pazienti trattati ha causato la lisi del tumore, in cui il nome che identifica questo gruppo di questo gruppo ha avuto proteine (TNF -α).
Circa 10 anni dopo, nel 1984, il gene del "fattore di necrosi tumorale" era isolato e caratterizzato, e nella stessa data un'altra proteina simile fu isolata e purificata nei linfociti T, che era chiamato "linfotossina T alfa" (TLα), che è stato successivamente rinomato come fattore TNF-β.
Al momento sono state definite numerose proteine simili al TNF originariamente descritto, che costituiscono la famiglia delle proteine TNF (tipo di fattore di necrosi tumorale) e comprese le proteine TNF-α, TNF-β, il ligando CD40 (CD40L), il ligando Fas ( Fasl) e molti altri.
[TOC]
Struttura
A livello genetico
Il gene codificante per la proteina TNF-α si trova nel cromosoma 6 (cromosoma 17 nei roditori) e quello che codifica per la proteina TNF-β precede il precedente in entrambi i casi (umani e roditori). Questi due geni sono in una singola copia e hanno una dimensione approssimativa di 3 kb.
In considerazione del fatto che la sequenza corrispondente alla regione promozionale del gene TNF-α ha diversi siti sindacali per un fattore di trascrizione noto come "fattore nucleare di kappa B" (NF-κB), molti autori considerano che la loro espressione dipende da questo fattore.
La regione del promotore del gene TNF-β, d'altra parte, ha una sequenza di unione per un'altra proteina nota come "gruppo 1 di mobilità 1" (HMG-1, dall'inglese Gruppo ad alta mobilità 1).
Può servirti: miosina: caratteristiche, struttura, tipi e funzioneA livello proteico
Sono state descritte due forme del fattore di necrosi del tumore alfa, una legata alla membrana (MTNF-α) e un'altra che è sempre solubile (STNF-α). Il fattore di necrosi beta tumorale, d'altra parte, esiste solo in forma solubile (STNF-β).
Nell'uomo, la forma membranale TNF-α è costituita da un polipeptide di poco più di 150 rifiuti di aminoacidi, che sono attaccati a una sequenza di "leader" di 76 aminoacidi aggiuntivi. Ha un peso molecolare apparente di circa 26 kDa.
La traslocazione di questa proteina sulla membrana si verifica durante la sua sintesi e questa forma viene "convertita" in forma solubile (17 kDa) da un enzima noto come "l'enzima di conversione di TNF-α", in grado di trasformare MTNF-α in STNF -α.
Meccanismo di azione
Le proteine appartenenti al gruppo di fattori di necrosi tumorale (TNF) esercitano le loro funzioni principalmente grazie alla loro associazione con recettori specifici nelle cellule del corpo umano e in altri animali.
Esistono due tipi di recettori per le proteine TNF nelle membrane plasmatiche di gran parte delle cellule del corpo, ad eccezione degli eritrociti: recettori di tipo I (TNFR-55) e recettori di tipo II (TNFR-75).
Entrambi i tipi di recettori condividono un'omologia strutturale rispetto al sito dell'Unione extracellulare per le proteine TNF e si legano anche a questi con affinità equivalente. Differiscono, quindi, nelle rotte di segnalazione intracellulare che si attivano una volta che si è verificato il processo di legame ligando-ricevitore.
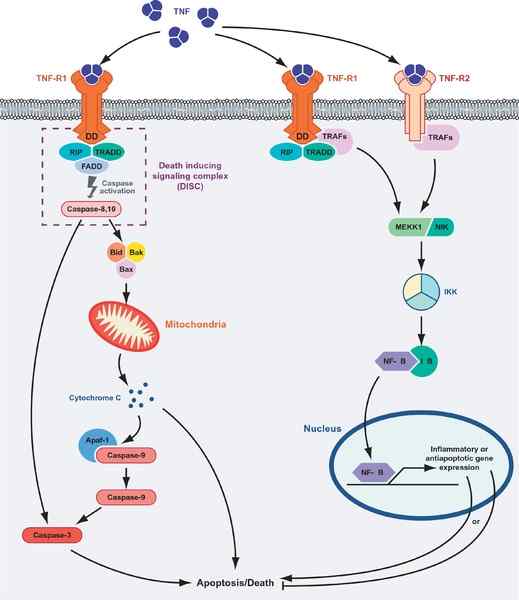 Morte cellulare o sopravvivenza mediata dalle proteine TNF. A sinistra del grafico viene mostrata la via apoptotica e la via di "sopravvivenza" (fonte: Masmudur M. Rahman, Grant McFadden/CC di (https: // creativeCommons.Org/licenze/by/1.0) via Wikimedia Commons)
Morte cellulare o sopravvivenza mediata dalle proteine TNF. A sinistra del grafico viene mostrata la via apoptotica e la via di "sopravvivenza" (fonte: Masmudur M. Rahman, Grant McFadden/CC di (https: // creativeCommons.Org/licenze/by/1.0) via Wikimedia Commons) L'interazione del recettore del ligando del TNF con uno qualsiasi dei suoi recettori promuove l'unione di tre recettori a un trigo solubile del TNF-α (trimerizzazione dei recettori) e detto interazione innesca le risposte cellulari anche quando solo il 10% dei recettori lo sono occupato.
Unione nei recettori di tipo I
L'unione recettore del ligando con recettori di tipo I funge da "piattaforma di reclutamento" di altre proteine di segnalazione nei domini citosolici dei recettori (la porzione interna). Tra queste proteine, la prima a "ottenere" è la proteina tradd o proteica con il dominio della morte associato al recettore TNFR-1 (inglese Proteina del dominio della morte associato a TNFR-1).
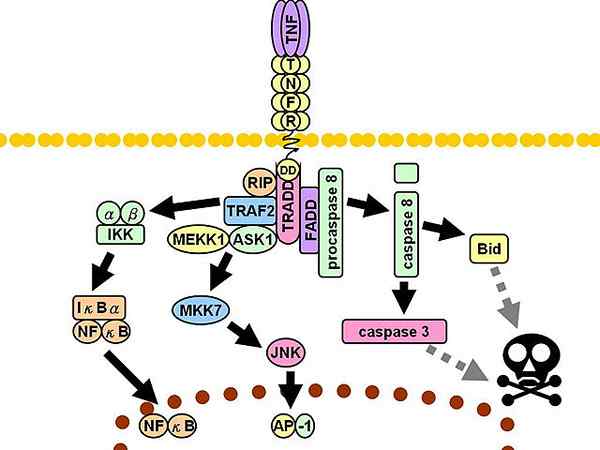 Percorso di segnalazione TNFR1. Le linee grigie discontinue rappresentano più passaggi.
Percorso di segnalazione TNFR1. Le linee grigie discontinue rappresentano più passaggi. Successivamente, vengono reclutati altri tre mediatori: proteina di interazione con il ricevitore 1 (RIP1, dall'inglese Proteina 1 che interrompe il ricevitore), Proteina con dominio di morte associato a FAS (FADD, inglese Proteina del dominio della morte associata alla FAS) e fattore 2 associato al ricevitore TNF (TRAF2, inglese Fattore 2 associato al recettore TNF).
Può servirti: fenilalanina: caratteristiche, funzioni, biosintesi, ciboRecettori di tipo II
Quando il TNF si lega ai recettori di tipo II, ciò si traduce nel reclutamento diretto della proteina TRAF2, che a sua volta recluta la proteina TRAF1. Queste proteine attivano le rotte proteiche MAPK (dall'inglese Proteina chinasi attivata dal mitogeno), molto importante dal punto di vista di segnalazione intracellulare negli eucarioti.
Molte delle rotte di segnalazione che sono attivate dopo l'unione dei fattori TNF ai loro recettori sono anche correlati all'attivazione di specifici fattori di trascrizione, che innescano risposte comuni che sono state descritte come "effetti" biologici delle proteine TNF.
Funzione
La proteina TNF-α è prodotta principalmente dai macrofagi del sistema immunitario, mentre la proteina TNF-β è prodotta dai linfociti T. Tuttavia, è stato dimostrato che anche altre cellule del corpo producono questi fattori, sebbene in misura minore.
Il fattore di necrosi tumorale è stato molto studiato per le sue implicazioni nei normali processi fisiologici, nonché nei processi patologici infiammatori acuti e cronici, nelle malattie autoimmuni e nei processi infiammatori legati a vari tipi di cancro.
Queste proteine sono legate a una rapida perdita di peso nei pazienti che soffrono di infezioni batteriche acute, che soffrono di cancro e che passano attraverso uno "scontro" settico.
Sono state descritte tre diverse attività biologiche per il fattore di necrosi tumorale:
- citotossicità contro le cellule tumorali
- Soppressione della lipasi lipoproteina degli adipociti (LPL) e
- Riduzione del potenziale di riposo della membrana dei miociti (cellule muscolari).
La forma membranale TNF-α promuove la citotossicità ed è stata coinvolta nelle attività paracrine del TNF in alcuni tessuti.
Quando viene percepito uno stimolo come endotossina batterica, questa forma è TNF attivo proteolipro nel siero e in altri fluidi corporei.
Può servirti: enzima: operazione ed esempiTra le sue funzioni biologiche, le proteine TNF possono anche contribuire all'attivazione e alla migrazione dei linfociti e dei leucociti, nonché a promuovere la proliferazione cellulare, la differenziazione e l'apoptosi.
Inibitori
Molti inibitori della proteina TNF della ricetta dei medici del trattamento a pazienti con malattie autoimmuni (terapia anti-TNF). Tra queste sostanze ci sono: infliximab, etanercept, adalimumab, golimumab e certolizumab pegol.
La forma di utilizzo più comune è per iniezioni sottocutanee nelle cosce o nell'addome e persino l'infusione venosa diretta viene praticata. Nonostante la quantità di queste sostanze può aiutare alcuni pazienti, ci sono alcuni effetti avversi associati al loro uso, tra cui un aumento del rischio di contrarre infezioni come la tubercolosi o altre infezioni fungine.
Inibitori non farmacologici "naturali"
Alcuni frammenti "tagliati" delle proteine TNF (tipo I e tipo II) hanno anche noto come proteine dell'Unione TNF (TNF-BPS, inglese Tumore alla necrosi del fattore di proteine leganti) sono stati rilevati nelle urine di pazienti con cancro, AIDS o sepsi.
In alcuni casi, questi frammenti inibiscono o neutralizzano l'attività delle proteine TNF, in quanto evitano l'interazione del recettore del ligando.
Altri inibitori "naturali" delle proteine TNF sono stati rilevati in alcuni prodotti vegetali derivati da curcuma e granata, sebbene gli studi siano ancora condotti a questo proposito.
Riferimenti
- Baud, v., & Karin, M. (2001). Trasduzione del segnale per fattore di necrosi tumorale e suoi parenti. Tendenze in biologia cellulare, 11 (9), 372-377.
- Chu, w. M. (2013). Tumore della necrosi del fattore. Cancer Lotters, 328 (2), 222-225.
- Kalliolias, g. D., & Ivkiv, L. B. (2016). Biologia TNF, meccanismi patogeni e strategie terapeutiche emergenti. Recensioni della natura Rheumatology, 12 (1), 49.
- Lis, k., Kuzawińska, o., & Bałkowiec -iskra e. (2014). Fattore di conoscenza degli inibitori del tumore della necrosi. Archives of Medical Science: AMS, 10 (6), 1175.
- Tracey, MD, K. J., & Cerami, ph. Dà. (1994). Fattore tumorale di necrosi: un citochina pleiototropica e bersaglio terapeutico. Revisione annuale della medicina, 45 (1), 491-503.
- Wu, h., & Hymowitz, s. G. (2010). Struttura e funzione del fattore di necrosi tumorale (TNF) sulla superficie cellulare. Nel manuale di segnalazione cellulare (PP. 265-275). Academic Press.
- « Struttura, Proprietà, Usi, Proprietà, Proprietà, Proprietà, Utili
- Qual è la teoria della storia o della storiologia? »

