Struttura primaria delle caratteristiche
- 4521
- 1350
- Benedetta Rinaldi
IL struttura primaria di proteine È l'ordine in cui sono disposti gli aminoacidi dei polipeptidi che comprendono. Una proteina è un biopolimero formato da monomeri α-aminoacidi uniti attraverso legami peptidici. Ogni proteina ha una sequenza definita di questi aminoacidi.
Le proteine svolgono un'enorme diversità di funzioni biologiche, tra cui la forma e mantengono l'integrità delle cellule attraverso il citoscheletro, difendono il corpo di strani agenti attraverso gli anticorpi e catalizzano le reazioni chimiche dell'organismo attraverso gli enzimi.
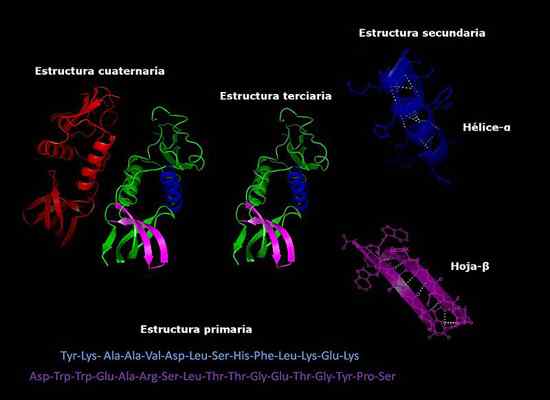
 Strutture primarie, secondarie, terziarie e quaternarie delle proteine, conformazione tridimensionale. Preso e curato da: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)].
Strutture primarie, secondarie, terziarie e quaternarie delle proteine, conformazione tridimensionale. Preso e curato da: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Attualmente, la determinazione della composizione delle proteine e l'ordine in cui sono disposti gli aminoacidi (sequenziamento) è più veloce di anni fa. Queste informazioni sono depositate in database elettronici internazionali, a cui è possibile accedere tramite Internet (Genbank, PIR, tra gli altri).
[TOC]
Aminoacidi
Gli aminoacidi sono molecole che contengono un gruppo amminico e un gruppo di acido carbossilico. Nel caso degli α-aminoacidi, hanno un atomo di carbonio centrale (carbonio α) a cui sono uniti, sia il gruppo amminico che il gruppo carbossilico, oltre a un atomo di idrogeno e un gruppo R distintivo, che si chiama lato catena.
A causa di questa configurazione del carbonio α, gli aminoacidi che si formano, noti come α-aminoacidi, sono chirali. Esistono due forme che sono immagini specchio l'una dell'altra e che sono chiamate enantiomeri L e D.
Tutte le proteine degli esseri viventi sono formati dalla configurazione di 20 α-aminoacidi L. Le catene laterali di questi 20 aminoacidi sono diverse e hanno una grande diversità di gruppi chimici.
Fondamentalmente, gli α-aminoacidi possono essere raggruppati (arbitrariamente) a seconda del tipo di catena laterale nel modo seguente.
Aminoacidi alifatici
In questo gruppo sono contenuti, secondo alcuni autori, glicina (GLI), alanina (ala), valina (val), leucina (Leu) e isoleucina (Ile). Altri autori includono anche metionine (MET) e Proline (Pro).
Può servirti: fosfolipidi: caratteristiche, struttura, funzioni, tipiAminoacidi con catene laterali contenenti idrossile o zolfo
Contiene la serina (ser), la cisteina (Cys), la treonina (thr) e anche la metionina. Secondo alcuni autori, il gruppo dovrebbe includere solo essere e thr.
Aminoacidi ciclici
Integrato solo dalla prolina, che, come già sottolineato, è incluso da altri autori tra gli aminoacidi alifatici.
Aminoacidi aromatici
Fenilalanina (PHE), tirosina (Tyr) e triphafano (TRP).
Aminoacidi di base
Histidine (His), Lisina (Lys) e Arginina (Arg)
Aminoacidi acidi e le sue ammidi
Contiene acidi aspartici (ASP) e glutammica (Glu) e anche aspargina (ASN) e glutammina (GLN). Alcuni autori separano quest'ultimo gruppo in due; Da un lato quello degli aminoacidi acidi (i primi due) e dall'altro quelli contenenti carbossilamide (i restanti due).
Collegamenti peptidici
Gli aminoacidi possono unirsi tra loro attraverso collegamenti peptidici. Questi collegamenti, chiamati anche collegamenti Amida, sono stabiliti tra il gruppo α-ammino di un aminoacido e il gruppo α-carbossilico di un altro. Questa unione si forma con la perdita di una molecola d'acqua.
L'unione tra due aminoacidi provoca la formazione di un dipéptide e se vengono aggiunti nuovi aminoacidi, sequenzialmente, tripidi, tetrapéptidi e così via.
I polipeptidi formati da un piccolo numero di aminoacidi, ricevono il nome generale degli oligopeptidi e se il numero di aminoacidi è elevato, i polipeptidi vengono chiamati.
Ogni aminoacido che viene aggiunto alla catena del polipeptide rilascia una molecola d'acqua. La parte dell'amminoacido che ha perso H+ o OH- durante l'Unione, è chiamata il resto dell'amminoacido.
La maggior parte di queste catene di oligopeptide e polipeptide presenterà, ad un'estremità, un gruppo amino-terminale (N-terminale) e nell'altro un carbossilico terminale (C-terminale). Oltre a ciò, possono contenere molti gruppi ionizzabili tra le catene laterali dei rifiuti di aminoacidi che li comprendono. Per questo motivo, i polianfoliti sono considerati.
Può servirti: flora e fauna di Campeche: specie rappresentative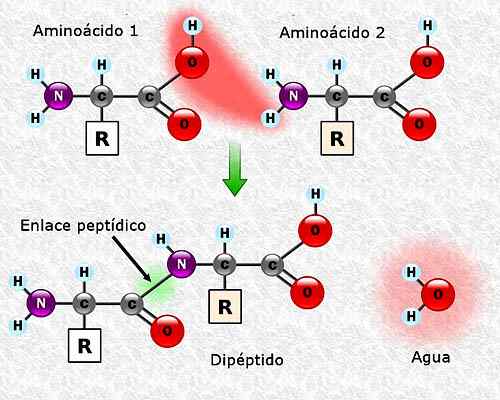 Formazione di un legame peptidico tra due aminoacidi. Preso e curato da: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)].
Formazione di un legame peptidico tra due aminoacidi. Preso e curato da: Alejandro Porto [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Sequenza di aminoacidi
Ogni proteina ha una certa sequenza dei suoi rifiuti di aminoacidi. Questo ordine è ciò che è noto come la struttura primaria della proteina.
Ogni singola proteina di ciascun organismo è specifica per la specie. Cioè, la mioglobina di un essere umano è identica a quella di un altro essere umano, ma ha piccole differenze con i mioglobine di altri mammiferi.
La quantità e i tipi di aminoacidi che una proteina contiene è importante quanto la posizione di questi aminoacidi all'interno della catena del polipeptide. Per conoscere le proteine, i biochimisti devono prima isolare e purificare ogni particolare proteina, quindi fare un'analisi del contenuto di aminoacidi e infine determinare la sua sequenza.
Per isolare e purificare le proteine ci sono metodi diversi, tra cui: centrifugazione, cromatografia, filtrazione in gel, dialisi e ultrafiltrazione, nonché l'uso di proprietà di solubilità proteica in studio.
La determinazione degli aminoacidi presenti nelle proteine viene eseguita dopo tre fasi. Il primo è rompere i legami peptidici mediante idrolisi. Successivamente, i diversi tipi di aminoacidi dalla miscela sono separati; E infine, ciascuno dei tipi di aminoacidi ottenuti viene quantificato.
Per determinare la struttura primaria della proteina, è possibile utilizzare diversi metodi; Ma attualmente il più utilizzato è il metodo di Edman, che consiste sostanzialmente nella marcatura e nella separazione dell'amminoacido N-terminale dal resto della catena ripetutamente e identifica ogni aminoacido rilasciato individualmente.
Codifica proteica
La struttura primaria delle proteine è codificata nei geni dell'organismo. Le informazioni genetiche sono contenute nel DNA, ma per la traduzione delle proteine deve essere prima trascritta alle molecole RNM. Ogni tripletta nucleotidica (codone) codifica un aminoacido.
Può servirti: qual è la composizione chimica degli esseri viventi?Poiché ci sono 64 possibili codoni e solo 20 aminoacidi vengono utilizzati nella costruzione di proteine, ogni aminoacido può essere codificato da più di un codone. Praticamente tutti gli esseri viventi usano gli stessi codoni per codificare gli stessi aminoacidi. Pertanto, il codice genetico è considerato un linguaggio quasi universale.
In questo codice, ci sono codoni usati per iniziare e fermare anche la traduzione del polipeptide. I codoni di completamento non codificano alcun aminoacido, ma fermano la traduzione nella catena C-terminale e sono rappresentati dalle terzine UAA, UAG e UGA.
D'altra parte, il codone AUG normalmente funziona come un segnale di avvio e codifica anche la metionine.
Dopo la traduzione, le proteine possono subire una certa elaborazione o modifica, come la mentalità breve, per ottenere la sua configurazione definitiva.
Riferimenti
- C.K. Mathews, k.E. Van Hold & K.G. Ahern. 2002. Biochemery. 3th Edizione. Benjamin / Cummings Publishing Company, Inc.
- Murray, p. Mayes, d.C. Granner & v.W. Rodwell. millenovecentonovantasei. Biochemery di Harper. Appleton & Lange
- J.M. Berg, j.L. Tymoczko & l. Stryer (SF). Biochemery. 5th Edizione. W. H. Freeman e compagnia.
- J. Koolman & K.-H. Roehm (2005). Atlante di colore biochimica. 2Nd Edizione. Thieme.
- A. Lechinger (1978). Biochimica. Omega Editions, s.A.
- L. Stryer (1995). Biochemery. W.H. Freeman and Company, New York.
- « Avogadro Number Cronologia, unità, come viene calcolato, usi
- Caratteristiche, struttura e funzioni di esonucleasi »

