Lewis struttura ciò che consiste, come è fatto, esempi

- 4537
- 1466
- Benedetta Rinaldi
IL Struttura di Lewis È tutto ciò che rappresentava legami covalenti all'interno di una molecola o uno ione. In esso, questi legami e elettroni sono rappresentati con lunghi punti o script, sebbene il più delle volte i punti corrispondano agli elettroni non condivisi e agli script ai legami covalenti.
Ma cos'è un collegamento covalente? È la condivisione di un paio di elettroni (o punti) tra due atomi della tavola periodica. Con questi diagrammi puoi disegnare molti scheletri per un determinato composto. Quale di loro è il giusto dipenderà dai carichi formali e dalla natura chimica degli stessi atomi.
 Composto a 2-bromopropan. Di Ben milioni [dominio pubblico], da Wikimedia Commons.
Composto a 2-bromopropan. Di Ben milioni [dominio pubblico], da Wikimedia Commons. Nell'immagine superiore c'è un esempio di cosa sia una struttura Lewis. In questo caso il composto rappresentato è 2-bromopropano. Si possono vedere i punti neri corrispondenti agli elettroni, sia quelli che partecipano ai collegamenti che quelli non condivisi (l'unica coppia appena sopra il BR).
Se i punti dei punti ":" fossero sostituiti da una lunga sceneggiatura "-", allora lo scheletro di carbonio del 2-bromopropano sarebbe rappresentato come: C-C-C. Perché invece della "cornice molecolare" disegnata, potrebbe essere C-H-H-C? La risposta sta nelle caratteristiche elettroniche di ciascun atomo.
Pertanto, poiché l'idrogeno ha solo un elettrone e un singolo orbitale disponibili per il riempimento, solo un legame covalente. Pertanto, non è mai possibile formare due legami (non confondere con i ponti idrogeno). D'altra parte, la configurazione elettronica dell'atomo di carbonio consente (e richiede) la formazione di quattro legami covalenti.
Per questo motivo, le strutture di Lewis in cui C e H devono essere coerenti e rispettare ciò che è governato dalle loro configurazioni elettroniche. In questo modo, se il carbonio ha più di quattro legami, o idrogeno più di uno, allora lo schizzo può essere escluso e avviarne uno nuovo in più in linea con la realtà.
È qui che compaiono alcune delle ragioni principali o di queste strutture, introdotte da Gilbert Newton Lewis nella loro ricerca di rappresentazioni molecolari fedeli ai dati sperimentali: la struttura molecolare e i carichi formali.
Tutti i composti esistenti possono essere rappresentati dalle strutture di Lewis, dando un primo approccio a come potrebbero essere la molecola o gli ioni.
[TOC]
Qual è la struttura di Lewis?
È una struttura rappresentativa di elettroni di Valencia e legami covalenti in una molecola o ione che serve ad avere un'idea della sua struttura molecolare.
Tuttavia, questa struttura non riesce a prevedere alcuni dettagli importanti come la geometria molecolare rispetto a un atomo e l'ambiente circostante (se è quadrato, piatto, bipiramidale, ecc.).
Inoltre non dice nulla riguardo a ciò che è l'ibridazione chimica dei suoi atomi, ma dove sono posizionati i doppi o i tripli legami e se c'è risonanza nella struttura.
Con queste informazioni puoi discutere sulla reattività di un composto, la sua stabilità, come e quale meccanismo la molecola seguirà quando reagi.
Per questo motivo le strutture di Lewis non smettono mai di essere considerate e sono molto utili, perché possono condensare il nuovo apprendimento chimico.
Com'è fatto?
Per disegnare o disegnare una struttura, una formula o un diagramma di Lewis, la formula chimica del composto è essenziale. Senza di essa non puoi nemmeno sapere quali sono gli atomi che lo compongono. Una volta con esso, la tabella periodica viene utilizzata per individuare quali gruppi appartengono.
Può servirti: viscosità: esempi, cause, unità, tipiAd esempio, se hai il composto C14O2N3 Quindi dovremmo cercare i gruppi in cui sono carbonio, ossigeno e azoto. Fatto questo, indipendentemente dal composto, il numero di elettroni di valenza rimane lo stesso, quindi prima o poi si memorizzano.
Pertanto, il carbonio appartiene al gruppo IVA, all'ossigeno al gruppo Via e all'azoto al VA. Il numero di gruppo è uguale alla quantità di elettroni (punti) di Valencia. Tutti hanno in comune la tendenza a completare l'ottetto dello strato di Valencia.
Qual è la regola dell'ottetto?
Questo dice che esiste una tendenza degli atomi per completare il suo livello di energia con otto elettroni per ottenere stabilità. Questo vale per tutti gli elementi non metallici o quelli che si trovano nei blocchi S o P della tabella periodica.
Tuttavia, non tutti gli elementi obbediscono alla regola dell'ottetto. Casi particolari sono metalli di transizione, le cui strutture sono più basate sui carichi formali e sul loro numero di gruppo.
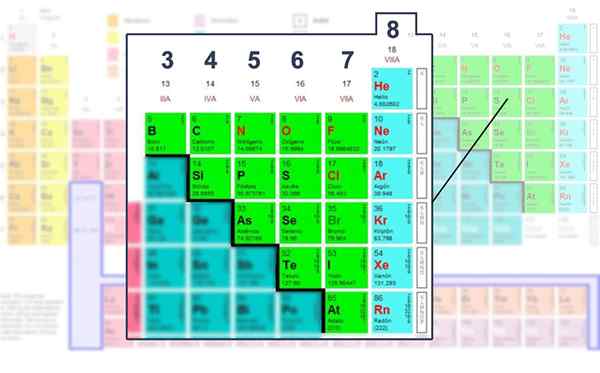 Numero di elettroni dello strato di Valencia degli elementi non metallici, quelli in cui possono essere gestiti con la struttura Lewis.
Numero di elettroni dello strato di Valencia degli elementi non metallici, quelli in cui possono essere gestiti con la struttura Lewis. Applicazione della formula matematica
Sapendo a quale gruppo appartengono gli elementi e, quindi, il numero di elettroni di valenza disponibili per formare collegamenti, viene realizzata la seguente formula, che è utile per disegnare le strutture di Lewis:
C = n - d
Dove c significa elettroni condivisi, Cioè, coloro che partecipano alle obbligazioni covalenti. Poiché ogni collegamento è costituito da due elettroni, allora C/2 è uguale al numero di collegamenti (o script) che devono essere disegnati.
N sono il elettroni necessari, Coloro che devono avere l'atomo nel suo strato di Valencia sono isolettronici per il gas nobile che segue nello stesso periodo. Per tutti gli elementi diversi da H (poiché richiede due elettroni per essere paragonato a lui) hanno bisogno di otto elettroni.
D sono il elettroni disponibili, che sono determinati dal gruppo o dal numero di elettroni di Valencia. Pertanto, poiché il CL appartiene al gruppo VIIA, deve essere circondato da sette neri o elettroni e tenere presente che è necessaria una coppia per formare un collegamento.
Avere gli atomi, i loro punti e il numero di collegamenti C/2, una struttura Lewis può quindi essere improvvisata. Ma inoltre, è necessario avere una nozione di altre "regole".
Dove posizionare gli atomi meno elettronegativi
Gli atomi meno elettronegativi nella stragrande maggioranza delle strutture occupano i centri. Per questo motivo, se hai un composto con atomi di p, o e f, la P deve quindi essere al centro della struttura ipotetica.
È anche importante evidenziare che gli idrogeni sono generalmente collegati ad atomi molto elettronegativi. Se hai in un composto Zn, H e O, l'H andrà accanto a O e non con Zn (Zn-O-H e NO H-Zn-O). Ci sono eccezioni a questa regola, ma di solito si verifica con atomi non metallici.
Simmetria e carichi formali
La natura ha un'alta preferenza per causare le strutture molecolari il più simmetriche possibile. Questo aiuta a evitare di allevare strutture disordinate, con gli atomi disposti in modo tale da non obbedire a qualsiasi modello apparente.
Può servirti: teorie del basso acido: arrhenius, bronsted-lowry, LewisAd esempio, per il composto C2A3, Dove A è un atomo immaginario, la struttura più probabile sarebbe a-c-a-c-a. Nota la simmetria dei loro lati, entrambi i riflessi dell'altro.
I carichi formali svolgono anche un ruolo importante quando si disegnano le strutture di Lewis, specialmente per gli ioni. Pertanto, i collegamenti possono essere aggiunti o rimossi in modo che il carico formale di un atomo corrisponda al carico totale visualizzato. Questo criterio è molto utile per i composti dei metalli di transizione.
Limitazioni nella regola dell'ottetto
 Rappresentazione di trifluoruro in alluminio, un composto instabile. Entrambi gli elementi sono costituiti da sei elettroni, che generano tre legami covalenti, quando dovrebbero avere otto per ottenere stabilità. Fonte: Gabriel Bolívar
Rappresentazione di trifluoruro in alluminio, un composto instabile. Entrambi gli elementi sono costituiti da sei elettroni, che generano tre legami covalenti, quando dovrebbero avere otto per ottenere stabilità. Fonte: Gabriel Bolívar Non tutte le regole sono rispettate, il che non significa necessariamente che la struttura non sia corretta. Esempi tipici di questo sono osservati in molti composti in cui sono coinvolti elementi del gruppo IIIA (B, al, Ga, in, TL). Qui è specificamente considerato l'alluminio trifluororo (ALF3).
Quindi applicando la formula sopra descritta, hai:
D = 1 × 3 (un atomo di alluminio) + 7 × 3 (tre atomi di fluoro) = 24 elettroni
Qui su 3 e 7 ci sono i rispettivi gruppi o numeri di elettroni di valenza disponibili per alluminio e fluoruro. Quindi, considerando gli elettroni necessari N:
N = 8 × 1 (un atomo di alluminio) + 8 × 3 (tre atomi di fluoro) = 32 elettroni
E quindi gli elettroni condivisi sono:
C = n - d
C = 32 - 24 = 8 elettroni
C/2 = 4 collegamenti
Poiché l'alluminio è l'atomo meno elettronegativo, deve essere posizionato al centro e il fluoro forma solo un collegamento. Considerando questo hai la struttura Lewis del Alf3 (Immagine superiore). Gli elettroni condivisi sono evidenziati con punti verdi per distinguerli dai non preparati.
Sebbene i calcoli prevedano che ci sono 4 collegamenti che devono essere formati, l'alluminio manca di elettroni sufficienti e non vi è nemmeno quarto atomo di fluoro. Di conseguenza, l'alluminio non è conforme alla regola dell'ottetto e questo fatto non si riflette nei calcoli.
Esempi di strutture di Lewis
Iodio
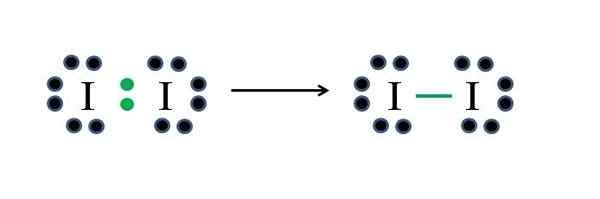 Iodo I non metal hanno sette elettroni ciascuno, quindi condividendo uno di quegli elettroni ciascuno, generano un legame covalente che dà loro stabilità. Fonte: Gabriel Bolívar
Iodo I non metal hanno sette elettroni ciascuno, quindi condividendo uno di quegli elettroni ciascuno, generano un legame covalente che dà loro stabilità. Fonte: Gabriel Bolívar Lo iodio è un alogeno e quindi appartiene al gruppo VIIA. Ha quindi sette elettroni di Valencia e questa semplice molecola diatomica può essere rappresentata a improvvisare o applicare la formula:
D = 2 × 7 (due atomi di iodio) = 14 elettroni
N = 2 × 8 = 16 elettroni
C = 16 - 14 = 2 elettroni
C/2 = 1 link
Poiché 14 elettroni 2 partecipano al legame covalente (punti verdi e script), 12 rimangono come non condivisi; E poiché sono due atomi di iodio, 6 devono essere distribuiti per uno di essi (i loro elettroni di valenza). In questa molecola è possibile solo questa struttura, la cui geometria è lineare.
Ammoniaca
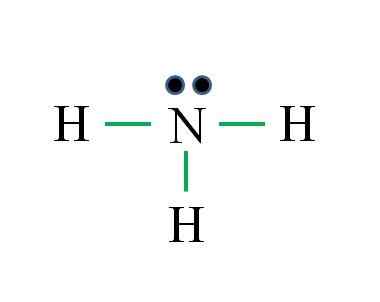 L'azoto ha 5 elettroni, mentre l'idrogeno solo 1. Sufficiente per ottenere stabilità quando vengono stabiliti tre legami covalenti, composti da un elettrone di N e un'altra di H Source: Gabriel Bolívar
L'azoto ha 5 elettroni, mentre l'idrogeno solo 1. Sufficiente per ottenere stabilità quando vengono stabiliti tre legami covalenti, composti da un elettrone di N e un'altra di H Source: Gabriel Bolívar Qual è la struttura di Lewis per la molecola di ammoniaca? Poiché l'azoto proviene dal gruppo VA, ha cinque elettroni di Valencia e poi:
Può servirti: termometro di laboratorio: caratteristiche, a cosa serve, uso, esempiD = 1 × 5 (un atomo di azoto) + 1 × 3 (tre atomi di idrogeno) = 8 elettroni
N = 8 × 1 + 2 × 3 = 14 elettroni
C = 14 - 8 = 6 elettroni
C/2 = 3 collegamenti
Questa volta la formula ha ragione con il numero di collegamenti (tre collegamenti verdi). A partire dagli 8 elettroni disponibili 6 partecipano ai legami, esiste una coppia non condizionata che si trova sopra l'atomo di azoto.
Questa struttura dice tutto ciò che dovrebbe essere conosciuto dalla base di ammoniaca. Applicando la conoscenza di TEV e TRPEV, ne consegue che la geometria è tetraedrica distorta dalla coppia di azoto libero e che l'ibridazione di questo è quindi SP3.
C2H6O
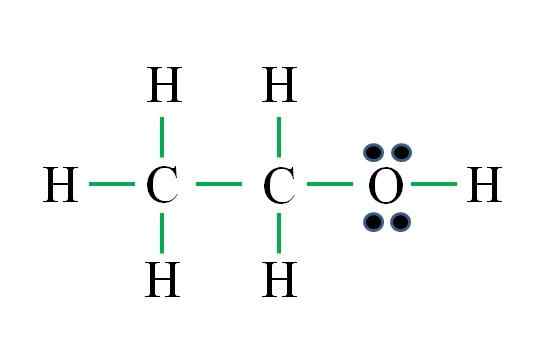 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar La formula corrisponde a un composto organico. Prima di applicare la formula, si dovrebbe ricordare che gli idrogeni formano un singolo legame, ossigeno due, carbonio quattro e che la struttura deve essere il più simmetrica possibile. Procedere come esempi precedenti sono:
D = 6 × 1 (sei atomi di idrogeno) + 6 × 1 (un atomo di ossigeno) + 4 × 2 (due atomi di carbonio) = 20 elettroni
N = 6 × 2 (sei atomi di idrogeno) + 8 × 1 (un atomo di ossigeno) + 8 × 2 (due atomi di carbonio) = 36 elettroni
C = 36 - 20 = 16 elettroni
C/2 = 8 collegamenti
Il numero di script verdi corrisponde agli 8 collegamenti calcolati. La struttura di Lewis proposta è quella di etanolo ch3Cap2OH. Tuttavia, sarebbe stato anche corretto proporre la struttura del dimetil etere3Och3, che è ancora più simmetrico.
Quale dei due è "più" corretto? Entrambi sono ugualmente, poiché le strutture sono sorte come isomeri strutturali della stessa formula molecolare C2H6O.
Ione permanganato
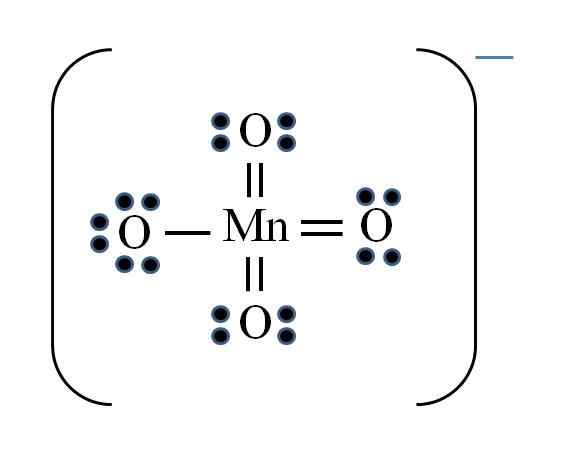 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar La situazione è complicata quando si desidera fare strutture Lewis per i composti di metallo di transizione. Il manganese appartiene al gruppo VIIB, inoltre, l'elettrone del carico negativo deve essere aggiunto tra gli elettroni disponibili. Applicazione della formula che hai:
D = 7 × 1 (un atomo di manganese) + 6 × 4 (quattro atomi di ossigeno) + 1 elettrone per carico = 32 elettroni
N = 8 × 1 + 8 × 4 = 40 elettroni
C = 40 - 32 = 8 elettroni condivisi
C/2 = 4 collegamenti
Tuttavia, i metalli di transizione possono avere più di otto elettroni a Valencia. Inoltre, per lo ione MnO4- Presenta il carico negativo, è necessario ridurre i carichi formali di atomi di ossigeno. COME? Attraverso i doppi collegamenti.
Se tutti i collegamenti di MNO4- Erano semplici, i carichi formali dell'ossigeno sarebbero uguali a -1. Dal momento che ce ne sono quattro, il carico risultante sarebbe -4 per l'anione, il che ovviamente non è vero. Quando si formano i doppi legami, è garantito che un singolo ossigeno abbia un carico formale negativo, riflesso nello ione.
Nello ione permanganato si può vedere che c'è risonanza. Ciò implica che l'unico semplice collegamento Mn-O è democalizzato tra i quattro atomi di O.
Ione dicromato
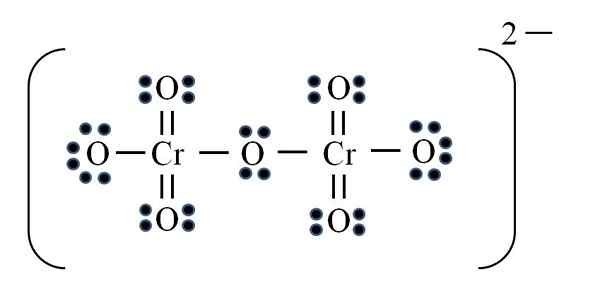 Fonte: Gabriel Bolívar
Fonte: Gabriel Bolívar Infine, un caso simile si verifica con lo ione dicromato (CR2O7). Il cromo appartiene al gruppo VIB, quindi ha sei elettroni di Valencia. Applicare di nuovo la formula:
D = 6 × 2 (due atomi cromati) + 6 × 7 (sette atomi di ossigeno) + 2 elettroni per il carico bivalente = 56 elettroni
N = 8 × 2 + 8 × 7 = 72 elettroni
C = 72 - 56 = 16 elettroni condivisi
C/2 = 8 collegamenti
Ma non ci sono collegamenti 8, ma 12. Per gli stessi motivi trovati, nello ione permanganato due ossigeno devono essere lasciati con carichi formali negativi che aggiungono uguali a -2, il carico dello ione dicromato.
Pertanto, poiché vengono aggiunti molti doppi collegamenti. In questo modo raggiungi la struttura Lewis dell'immagine per il CR2O72-.
Riferimenti
- Whitten, Davis, Peck e Stanley. Chimica. (8 ° ed.). Cengage Learning, p 251.
- Strutture Lewis. Tratto da: chimico.Chimica.Purdue.Edu
- Steven a. Hardinger, Dipartimento di Chimica e Biochimica, UCLA. (2017). Struttura di Lewis. Tratto da: Chem.Ucla.Edu
- Wayne Breslyn. (2012). Disegnare le strutture di Lewis. Tratto da: terpconnect.UMD.Edu
- Webmaster. (2012). Strutture Lewis ("Electron Dot"). Dipartimento di Chimica, Università del Maine, Orono. Tratto da: chimica.Umeche.Maine.Edu
- Lancaster, Sean. (25 aprile 2017). Come determinare quanti punti ci sono sulla struttura del punto Lewis di un elemento. Scientifico. Recuperato da: scientifici.com
- « Caratteristiche ed esempi dell'amministrazione privata
- Teorie dell'apprendimento Caratteristiche e autori principali »

