Struttura di enolasi, meccanismo d'azione, funzioni
- 697
- 11
- Rufo Longo
IL Enolasi È l'enzima incaricato di eseguire la conversione del fosfoglicerato D-2 (2PGA) nel fosfoenolpiruvato (PEP) nella glicolisi e della reazione inversa nella gluconeogenesi, due percorsi metabolici che fanno parte del metabolismo dell'energia cellulare.
La decisione di catalizzare questa reazione in una o un'altra direzione dipende dall'accesso che la cellula al glucosio ha. Cioè, delle esigenze di adattamento del metabolismo al degrado o alla sintesi al fine di ottenere energia. Indispensabile per la realizzazione dei suoi processi vitali.
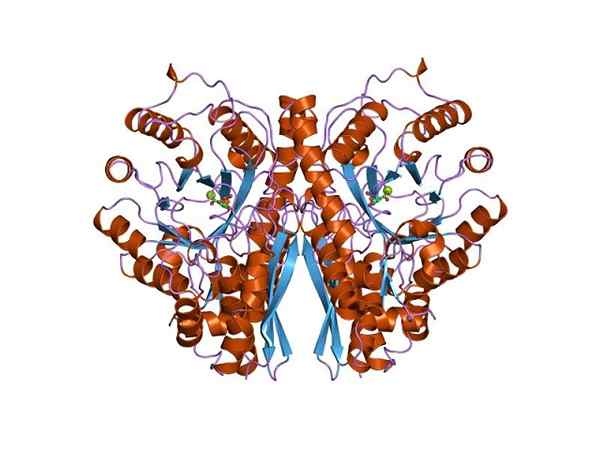
 Struttura a tre dimensioni di Enolasa. Di Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Public Domain (https: // creativeCommons.Org/licenze/by-sa/4.0)], da Wikimedia Commons.
Struttura a tre dimensioni di Enolasa. Di Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Public Domain (https: // creativeCommons.Org/licenze/by-sa/4.0)], da Wikimedia Commons. Poiché entrambe le rotte metaboliche appartengono al centro dell'albero metabolico centrale degli esseri viventi, non è strano che la sequenza di aminoacidi di questa proteina sia conservata in archea, batteri ed eucarioti. E quindi che presentano proprietà catalitiche simili.
La posizione dell'enolasi nella cellula è limitata al citosol, un compartimento in cui si svolgono sia la glicolisi (chiamata anche glicolisi) sia la gluconeogenesi.
Tuttavia, è stato rilevato anche in altri compartimenti cellulari come la membrana plasmatica di molte cellule tumorali e cellule. Lì, sembra essere coinvolto nella facilitazione dei processi di diffusione delle cellule, una funzione totalmente diversa dalla sua funzione classica.
Gli enzimi in grado di eseguire più di una funzione, come fa Enolase, sono noti come enzimi al chiaro di luna.
[TOC]
Struttura
La struttura quaternaria del linus o meno nei suoi ligandi è stata determinata in un gran numero di individui procariotici ed eucariotici.
Ogni monomero presenta due domini: un piccolo dominio amino-terminale e un dominio carbossil-terminale più grande. Il dominio N-terminale è composto da tre fogli α e quattro β. Mentre, il terminale C è costituito da otto fogli β che si alternano tra loro che formano un β-barrel che è circondato da otto eliche α.
Inoltre, in ciascun monomero si trovano due siti sindacali per cationi bivalenti che sono stati chiamati "sito conformazionale" e "sito catalitico". Il primo non è molto selettivo e può unirsi a un'ampia varietà di cationi bivalenti in assenza di substrato.
Può servirti: sfingolipidi: cosa sono, caratteristiche, funzioni, sintesiMentre il secondo si lega agli ioni dopo il substrato si è unito all'enzima. L'unione degli ioni in entrambi i siti è vitale per la reazione di procedere.
Infine, è importante menzionare che negli omodimeri i monomeri sono uniti mantenendo un orientamento parallelo. Pertanto, il sito attivo è limitato alla regione centrale formata da detto unione.
Tuttavia, solo uno dei due monomeri partecipa alla catalisi. Ciò spiega che la capacità dei monomeri di eseguire la reazione in condizioni sperimentali.
Meccanismo di azione
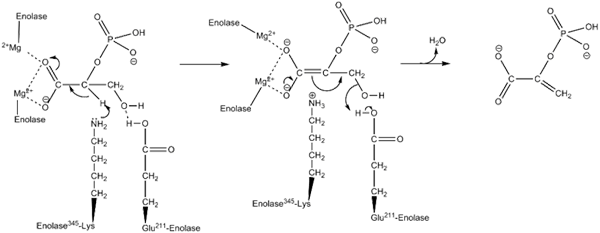 Meccanismo d'azione utilizzato dall'enzima inolasi. Di Kthompson08 in inglese Wikipedia [Dominio pubblico (https: // creativeCommons.Org/licenze/by-sa/4.0)], da Wikimedia Commons.
Meccanismo d'azione utilizzato dall'enzima inolasi. Di Kthompson08 in inglese Wikipedia [Dominio pubblico (https: // creativeCommons.Org/licenze/by-sa/4.0)], da Wikimedia Commons. Studi strutturali, così come quelli che hanno permesso di determinare le caratteristiche cinetiche e fisico -chimiche di Enolasa, ci hanno permesso di comprendere il loro meccanismo d'azione.
Il modo in cui l'enzima esegue la catalisi della reazione è piuttosto interessante. Sebbene sia coinvolto un singolo substrato, un meccanismo sequenziale ordinato è quello che è stato proposto.
Questo inizia con l'unione di uno ione di Mg2+ al sito conformazionale di uno dei monomeri. Continuo con l'unione del substrato al sito attivo seguito dall'unione di un secondo ione nel sito catalitico e si conclude con la pronta rilascio del prodotto una volta che la reazione è stata effettuata. A questo punto, MG2+ rimane collegato al sito conformazionale.
Lungo le stesse linee, per favorire la realizzazione della reazione l'enzima medio in primo luogo la generazione di un intermediario Carbanion, eliminando un protone del carbonio 2 del 2PGA. Questo lo fa grazie all'azione di un residuo di aminoacido di base.
In sequenza, la rimozione di idrossile di carbonio 3 avviene dall'azione di un residuo acido dall'enzima. A questo punto, l'unione di entrambi i carboni viene effettuata mediante un doppio legame che forma PEP. In questo modo la reazione è culminata.
Può servirti: Monera Kingdom: caratteristiche, classificazione ed esempiFunzioni
Molti degli enzimi finora studiati sono in grado di svolgere un'ampia varietà di funzioni non correlate alla loro "funzione classica" in diversi compartimenti cellulari. Questi enzimi sono stati chiamati enzimi "Moonlighting".
In questo senso, Enolasi può essere considerata come una luce del luna enzimatica, poiché numerose funzioni contrarie alla loro funzione classica sono state attribuite fino ad oggi sia nei batteri che nei batteri.
Alcune di queste funzioni sono le seguenti:
- Partecipa al mantenimento della forma cellulare e al traffico vescicolare quando interagisci con le proteine del citoscheletro.
- Nel nucleo delle cellule di mammifero funge da fattore di trascrizione che regola l'espressione dei geni associati alla proliferazione cellulare. Collaborare nel mantenimento della stabilità dell'RNM nel degrado nei batteri.
- In agenti patogeni, come Streptococcus pneumoniae E Trypanosoma cruzi, Sembra che funzioni come un importante fattore di virulenza.
- È stato anche trovato che in Streptococcus pyogenes, Enolasi viene escreta sul mezzo extracellulare che facilita la degradazione del tessuto e l'evasione del sistema ospite.
- Sulla superficie delle cellule tumorali è espresso migliorando le metastasi.
Enolasi e la sua relazione con i meccanismi di diffusione delle cellule
Numerosi agenti patogeni, così come le cellule tumorali, si esprimono nella loro membrana o esplodono le proteasi dei terreni extracellulari in grado di degradare le proteine proteiche.
Questa capacità consente a queste cellule di sfondare i tessuti e diffondersi rapidamente durante l'intero organismo ospite. Favorire così l'evasione del sistema immunitario e quindi l'istituzione dell'infezione.
Anche quando Enolasa manca di attività di proteasi, partecipa al processo di diffusione di molti agenti patogeni nel suo ospite e nelle cellule tumorali durante i goalstastasi.
Questo lo raggiunge grazie al fatto che è espresso sulla superficie di queste cellule che funzionano come recettore del plasminogeno. Quest'ultimo è lo zimogano di una proteasi serina nota come plasminata che fa parte del sistema fibrinolitico e agisce degradando le proteine della matrice extracellulare.
Pertanto, l'enolasi espressa in superficie è una strategia che queste cellule hanno acquisito per stabilire l'infezione e diffondersi con successo.
Può servirti: Simpatric Speciation: Concept, Caractistics ed EsempiQuesta strategia consiste in due processi:
- L'evasione del sistema immunitario dell'ospite. Poiché, quando queste cellule di una proteina ospite sono rivestite, vengono ignorate da cellule del sistema immunitario che riconoscono patogeni non dotati associati a patogeni.
- Diffusione post-azione del plasminogeno nel plasmine. La cui partecipazione alla degradazione delle proteine della matrice extracellulare, quindi facilita la diffusione rapida ed efficace.
Riferimenti
- Avilan L, Gualdron-Lopez M, Quiñones W, González-González L, Hannaert V, Michels PAA, Concepción JL. Enolasi: un attore chiave nel metabolismo e un probabile fattore di virulenza dei parassiti di tripanosomatidi per il suo uso come bersaglio terapeutico. Ricerca enzimatica. 2011 vol. Articolo ID932549, 14 pagine.
- Bhowmick I, Kumar N, Sharma S, Coppens I, Jarori GK, Plasmodium falciparum enosoase: espressione specifica dello stadio e localizzazione sub -cellulare. Malaria Journal. 2009; 8 (1). Articolo 179.
- Giorno I, Peshavaria M, Quinn GB, un orologio molecolare differenziale nell'evoluzione dell'isoproteina ENOASE. Journal of Molecular Evolution. 1993; 36 (6): 599-601.
- della torre-scuder E, Manzano-Román R, Pérez-Sánchez R, Siles-Lucas M, Olega A. Clonazione e caratterizzazione della Enolase associata alla superficie che lega il plasminogeno da Schistosoma Bovis. Parassitologia veterinaria. 2010; 173: 73-84.
- Dinovo EC, Boyer PD. Sonde isotopiche del meccanismo di reazione enolasi. Tassi di cambio di isotopi iniziali ed equilibri: effetti di isotopi primari e secandari. J Biol Chem. 1971; 246 (14): 4586-4593.
- Kaberdin VR, Lin-Chao S, svelando nuovi ruoli per componenti minori della E. Coli RNA Degraduate. Biologia dell'RNA. 2009; 6 (4): 402-405.
- Keller A, Peltzer J, Carpentier G. Interazioni di Enolas. Biochimica et Biophysica Acta. 2007; 1770 (6): 919-926.
- Lung J, Liu KJ, Chang JY, Leu SJ, Shih NY. MBP-1 è codificato efficacemente da una trascrizione alternativa del gene enRi1 Buttranslationally-regolato da uno spostamento proteico proteasoma-dipendente. FEBS Journal. 2010; 277 (20): 4308-4321.
- Pancholi v. Α-enolasi multifunzionale: il suo ruolo nelle malattie. Scienze della vita cellulare e molecolare. 2001; 58 (7): 902-920.
- Poyner RR, Cleland WW, Reed GH. Ruolo del metallo INS nella catalisi da parte dell'enolasi. Un meccanismo cinetico ordinato per un singolo enzima del substrato. Biochimica. 2001; 40: 9008-8017.
- Segovia-Gamboa NC, Chávez-Munguía B, Medina-Flores A, Entamoeba invadens, Processo di incistatazione ed enolasi. Parassitologia sperimentale. 2010; 125 (2): 63-69.
- Tanaka M, Sugisaki K, Nakashima K, trasformando i livelli di mRNA traducibili per isozimi di enoasi durante lo sviluppo del muscolo scheletrico di Chickn. Comunicazioni di ricerca biochimica e biofisica. 1985; 133 (3): 868-872.

