Forte concetto di elettroliti, caratteristiche, esempi

- 2389
- 451
- Cosetta Messina
UN Elettrolita forte È tutta quella sostanza che si è dissolta in acqua, o in un solvente specifico, è completamente dissociata sugli ioni. Pertanto, non dovrebbe esserci una soluzione come molecole neutre o come solidi insolubili. Un elettrolita forte può essere un sale, un acido o una base, a condizione che si dissociano o completamente ionico.
L'esempio più rappresentativo di un elettrolita è sale comune, cloruro di sodio, NaCl. In soluzione acquosa, i cristalli di NaCl si dissociano nella loro interezza per produrre ioni Na+ e cl-, che finiscono per circondare le molecole d'acqua. Si dice quindi che un sale si comporta come un forte elettrolita quando la sua solubilità è molto alta in acqua.
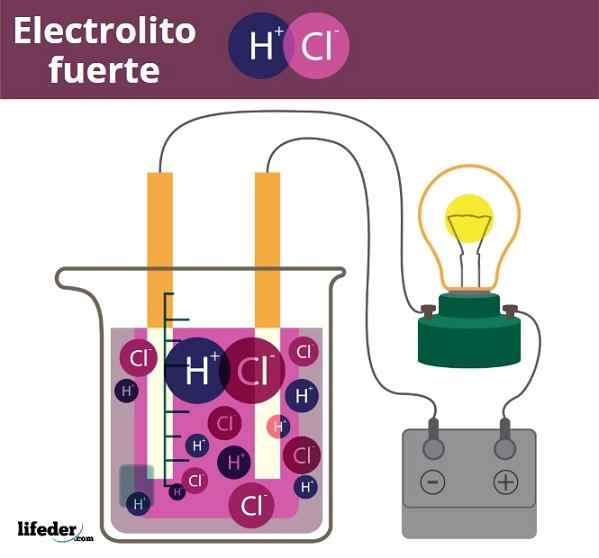 Esempio di elettrolite Fuero. HCl, acido cloridrico, rilascio di ioni H3O+ e CL-
Esempio di elettrolite Fuero. HCl, acido cloridrico, rilascio di ioni H3O+ e CL- Un po 'simile è il caso di acidi e basi. Quando questi sono forti, le loro soluzioni in acqua producono la massima quantità possibile di ioni H3O+ o oh-, Quindi i cambiamenti del pH sono bruschi. Esempi di acidi e basi forti sono acido nitrico, HNO3, e idrossido di potassio, KOH, rispettivamente.
È importante sapere come identificare elettroliti forti durante la preparazione di soluzioni ioniche molto o mezzi di base molto forti.
[TOC]
Caratteristiche di elettroliti forti
Solubilità
Elettroliti forti sono caratterizzati da sostanze acquatiche estremamente solubili. Sia solidi o gas, quando si entra in contatto con l'acqua, non dovrebbe essere ritardato troppo per dissolversi completamente. Se un sale, ad esempio, è poco solubile in acqua, può essere scartato come un forte elettrolita.
Conducibilità ionica
Gli elettroliti forti non sono solo molto solubili in acqua, ma generano anche un gran numero di ioni. Grazie alle cariche elettriche di questi ioni, gli elettroni possono percorrere comodamente le soluzioni. Ciò si riflette in un aumento della conduttività ionica rispetto all'acqua pura. Ecco perché le soluzioni ioniche conducono molto bene l'elettricità.
Può servirti: cloro: storia, proprietà, struttura, rischi, usiNeutralità salina
Molti elettroliti forti salini, quando si dissolvono in acqua, non producono alcun cambiamento di pH. Ciò significa che le soluzioni di questi sali non sono acide o basilari, ma neutri, con un pH vicino a 7.
Tuttavia, potrebbero esserci acidi o sali di base che sono facilmente dissolti in acqua e che generano anche ioni completi. Ad esempio, carbonato di sodio2Co3, Si dissolve per generare ioni Na+ e co32-, Ma il pH della soluzione è di base.
Esempi di elettroliti forti
 Il cloruro di sodio è l'esempio più rappresentativo di un forte elettrolita. Fonte: Cristian V. /CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0)
Il cloruro di sodio è l'esempio più rappresentativo di un forte elettrolita. Fonte: Cristian V. /CC BY-SA (https: // creativeCommons.Org/licenze/by-sa/4.0) Gli elettroliti forti, essendo così tanti, sono divisi in tre classificazioni: acidi forti, basi forti e prodotti di sali solubili di neutralizzazioni tra i primi due.
Acidi forti
Acidi forti durante la dissoluzione in acqua, senza alcun problema, devono produrre la massima quantità possibile di h3O+, Quindi l'acido deve essere completamente ione; cioè, non dovrebbe esistere come molecola neutra con protoni acidi senza rilasciare.
Esempi di questi acidi sono:
-HCl, acido cloridrico, rilascia ioni H3O+ e cl-
-HF, acido fluorico, rilascia ioni H3O+ e f-
-Hno3, Acido nitrico, rilascio henes h3O+ e non3-
-HCLO4, acido perlorico, rilascia ioni H3O+ e clo4-
-Hio4, acido periódic, rilascia ioni H3O+ e io4-
-H2SW4, acido solforico, rilascio henes h3O+ E così42-
Il motivo per cui lo ione idroelescenziale, h3O+, È sempre presente (in un modo o nell'altro), è perché l'idrogeno che donano viene ricevuto da una molecola d'acqua:
HCL + H2O → h3O+ + Cl-
La reazione è diretta e irreversibile. Questa è una caratteristica di un forte acido, che a sua volta è un forte elettrolita a causa della sua piena ionizzazione in acqua.
Può servirti: idrocarburi alifatici: proprietà, nomenclatura, reazioni, tipiBasi forti
Basi forti, dissolvendo in acqua senza alcun problema, devono rilasciare ioni OH- Dagli stessi cristalli o irreversibilmente figura una molecola d'acqua per generarli.
Molte basi forti sono costituite da solidi ionici e non molecolari. Alcuni esempi di queste basi che si comportano come elettroliti forti sono:
-Lioh, idrossido di litio, rilascia ioni OH- e li+
-NaOH, idrossido di sodio, rilascia ioni OH- e na+
-Rboh, rubido idrossido, rilascia ioni OH- e Rb+
-Ca (Oh)2, idrossido di calcio, rilascio di ioni OH- e ca2+
-Sr (oh)2, Idrossido di stronzio, rilascio di ioni OH- e Mr2+
-Ba (oh)2, idrossido di bario, rilascio di ioni OH- e ba2+
-Nah, idruro di sodio, rilascia ioni oh- e idrogeno gas, h2
-Nanh2, sodio amiduro, rilascio oh ioni- e ammoniaca gas, NH3
Esci
Hallobasi forti elettroliti quando si dissolve in acqua deve essere completamente ione. Molti di loro non producono cambiamenti di pH. Questo perché i loro ioni sono molto stabili, quindi non partecipano ai saldi dell'idrolisi per cambiare la natura dell'acqua. Esempi di questi sali sono:
-NaCl, cloruro di sodio, rilascia ioni Na+ e cl-
-Agno3, Nitrato d'argento, ioni di rilascio+ e non3-
-Fratello maggiore3, nitrato di sodio, rilascio di na ioni+ e non3-
-K2SW4, solfato di potassio, rilascia K ioni+ E così42-
-MGCL2, Cloruro di magnesio, rilascia ioni mg2+ e cl-
-Cuso4, Solfato cuprico, rilascia ioni Cu2+ E così42-
-KBR, bromuro di potassio, rilascia K ioni+ e br-
-NH4Cl, cloruro di ammonio, rilascia ioni NH4+, Cl-, H3O+ e gas ammoniaca
Può servirti: cloruro di mercurio (ii): struttura, proprietà, ottenimento, usi-Nacn, cianuro di sodio, rilascia ioni Na+ e cn-
-N / a3Po4, sodio fosfato, rilascia ioni Na+ e Po43-
-CRCL3, Cloruro cromico, rilascia ioni CR3+ e cl-
-AUB3, Bromuro aurico, rilascia ioni Au3+ e br-
-Snso4, Estany solfato, rilascia ioni Sn2+ E così42-
Il NH4CL è un esempio contraddittorio: è completamente ionizzato, ma allo stesso tempo genera molecole neutre di ammoniaca perché è un sale acido.
Differenze tra elettroliti forti e deboli
Sebbene le differenze tra un forte elettrolita di un debole siano state stabilite indirettamente, queste saranno presentate di seguito come una conclusione:
-Gli elettroliti forti sono molto solubili nelle acque; Gli elettroliti deboli non lo sono.
-La ionizzazione di un elettrolita debole è parziale, il che significa che potrebbero esserci molecole neutre in soluzione. Invece, elettroliti forti esistono esclusivamente come ioni.
-Gli acidi e le basi deboli, che a loro volta sono elettroliti deboli, non si dissociano completamente in acqua, quindi generano meno ioni h3O+ o oh- Cosa ci si potrebbe aspettare.
-Halth -Hilin elettroliti forti non sono quasi idrolizzati rispetto agli elettroliti deboli. Pertanto, le soluzioni del primo tendono ad essere neutrali, tranne quando si occupano di acidi o sali di base.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Wikipedia. (2020). Elettrolita forte. Recuperato da: in.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11 febbraio 2020). Forte definizione ed esempio di elettroliti. Recuperato da: Thoughtco.com
- Chung & Chieh. (5 giugno 2019). Elettroliti. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- « Caratteristiche di valutazione esterna, tipi (test), esempi
- Platone Biografia, filosofia e contributi »

