Kernel Electronic Configuration Construction, Esempi
- 3015
- 434
- Zelida Gatti
IL Configurazione elettronica del kernel o compatto è che le cui notazioni quantistiche del numero di elettroni e dei loro sotto -livelli di energia sono abbreviati dai simboli di gas nobili in parentesi quadrate. È molto utile quando si scrivono configurazioni elettroniche per un determinato elemento, in quanto è semplice e veloce.
La parola "kernel" di solito si riferisce agli strati interni elettronici di un atomo; Cioè, quelli in cui i loro elettroni non provengono da Valencia e quindi non partecipano al legame chimico, sebbene definiscano le proprietà dell'elemento. Metaforicamente parlando, il kernel sarebbe l'interno della cipolla, con i suoi strati composti da una serie di orbitali in crescita in energia.
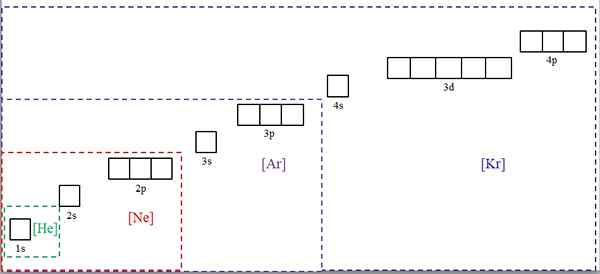
 Configurazioni elettroniche abbreviate con i simboli di gas nobili. Fonte: Gabriel Bolívar.
Configurazioni elettroniche abbreviate con i simboli di gas nobili. Fonte: Gabriel Bolívar. L'immagine superiore mostra simboli chimici per quattro dei gas nobili tra parentesi quadrate e con colori diversi: [he] (verde), [ne] (rosso), [ar] (viola) e [kr] (blu) (blu).
Ciascuno dei suoi frame punteggiati contiene caselle che rappresentano gli orbitali. Maggiore è il numero maggiore di elettroni contenenti; che a sua volta significherà che le configurazioni elettroniche di più elementi possono essere semplificate con questi simboli. Questo consente di risparmiare tempo ed energia scrivendo tutte le notazioni.
[TOC]
Ordine di costruzione
Prima di utilizzare le configurazioni elettroniche del kernel, è conveniente rivedere l'ordine corretto di creare o scrivere queste configurazioni. Questo è governato secondo la regola diagonale o il diagramma Moeller (chiamato in alcune parti della pioggia). Avendo questo diagramma a portata di mano, le notazioni quantistiche rimangono come segue:
1S 2S 2P 3S 3P 4S 3D 4P 5S 4D 5P 6S 4F 5D 6P 7S 5F 6D 7P
Può servirti: sali di base: formula, proprietà, nomenclatura, esempiQuesta fila di notazioni quantistiche sembra esaurita; E sarebbe ancora di più se dovessi scriverlo ancora per essere rappresentato la configurazione elettronica di qualsiasi elemento che è stato trovato nel periodo 5 in poi. Si noti che la riga è vuota di elettroni; Non ci sono numeri ai diritti dei diritti superiori (1S22s22 p6...).
Va ricordato che gli orbitali S può "ospitare" due elettroni (NS2). Gli orbitali P Ce ne sono tre in totale (guarda le tre scatole sopra), in modo che possano ospitare sei elettroni (NP6). E infine, gli orbitali D Ce ne sono cinque e il F sette, con un totale di dieci (ND10) e quattordici (NF14) elettroni, rispettivamente.
Abbreviazione di configurazione elettronica
Detto questo, la fila anteriore delle notazioni quantistiche è riempita di elettroni:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
Quanti elettroni ci sono in totale? 118. E quale elemento corrisponde a una quantità così enorme di elettroni nel suo atomo? Al nobile gas oganese, OG.
Supponiamo che ci sia un elemento con un numero quantico z pari a 119. Quindi, la sua configurazione elettronica di Valencia sarebbe 8s1; Ma quale sarebbe la sua configurazione elettronica completa?
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6 8s1
E quale sarebbe la tua configurazione elettronica del kernel, la compatta? Questo:
[OG] 8s1
Nota l'ovvia semplificazione o abbreviazione. Nel simbolo [OG] vengono contati tutti gli 118 elettroni scritti sopra, quindi questo elemento incerto ha 119 elettroni, di cui solo uno proviene da Valencia (si troverebbe sotto il Francia nella tabella periodica).
Può servirti: cos'è una soluzione satura? (Con esempi)Esempi
Generale
Supponiamo ora che tu voglia eseguire progressivamente l'abbreviazione:
[Lui] 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
Nota che 1s2 È stato sostituito da [lui]. Il prossimo gas nobile è il neon, che ha 10 elettroni. Sapendo questo, l'abbreviazione continua:
[Ne] 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
Quindi segui l'argon, con 18 elettroni:
[Ar] 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
Poiché il prossimo gas nobile è il kripton, altri 36 elettroni sono avanzati:
[Kr] 5s2 4d10 5 p6 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
Lo xeno ha 54 elettroni e quindi spostiamo l'abbreviazione sull'orbitale 5p:
[Xe] 6s2 4f14 5 D10 6p6 7s2 5f14 6d10 7p6
A questo punto la configurazione elettronica è sempre abbreviata all'orbitale NP; Cioè, i gas nobili hanno questi orbitali pieni di elettroni. E finalmente segui il radon, con 86 elettroni, quindi abbreviamo l'orbitale 6p:
[RN] 7s2 5f14 6d10 7p6
Ossigeno
L'ossigeno ha otto elettroni, essendo la sua configurazione elettronica completa:
1s22s22 p4
L'unica abbreviazione che possiamo usare è [lui] di 1s2. Pertanto, la sua configurazione elettronica del kernel è:
[Lui] 2s22 p4
Potassio
Il potassio ha diciannove elettroni, essendo la sua configurazione elettronica completa:
Può servirti: da dove viene la plastica? Storia e tipi1s2 2s2 2 p6 3s2 3p6 4s1
Si noti che possiamo usare il simbolo [lui] per abbreviare tale configurazione; così come [ne] e [ar]. Quest'ultimo è ciò che viene usato perché l'argon è il gas nobile che lo precede più vicino al potassio. Pertanto, la sua configurazione elettronica del kernel rimane:
[Ar] 4s1
indiano
L'India ha quaranta elettroni Nine, essendo la sua configurazione elettronica completa:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p1
Poiché il Kripton è il gas nobile più vicino che precede l'indiano, viene utilizzato il simbolo [KR] per l'abbreviazione e si verifica la sua configurazione elettronica del kernel:
[Kr] 5s2 4d10 5 p1
Sebbene gli orbitali 4D non appartengano formalmente al kernel indiano, i loro elettroni non intervengono (almeno in condizioni normali) nel loro legame metallico, ma quelli di 5s e 5p orbitali.
Tungsteno
Il tungsteno (o Wolframio) ha 74 elettroni e la sua configurazione elettronica completa è:
1s2 2s2 2 p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5 p6 6s2 4f14 5 D4
Ancora una volta, cerchiamo il gas nobile più vicino. Nel suo caso, corrisponde a Xenón, che ha i suoi orbitali 5p completi. Pertanto, sostituiamo la riga delle notazioni quantistiche con il simbolo [xe] e finalmente avremo la sua configurazione elettronica del kernel:
[Xe] 6s2 4f14 5 D4
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Pat Thayer. (2016). Diagrammi di configurazione elettronica. Recuperato da: chimica.org
- Helmestine, Anne Marie, PH.D. (5 dicembre 2018). Definizione del nucleo di gas nobile. Recuperato da: Thoughtco.com/
- Wikipedia. (2019). Configurazione elettronica. Recuperato da: è.Wikipedia.org
- « Storia della discoteca dell'uranio e cantanti che l'hanno vinta
- Storia dell'esperimento di Tuskegee, motivi e critiche »

