Struttura, proprietà, rischi, usi, usi, usi, usi, usi del sodio

- 3100
- 832
- Silvano Montanari
Lui Cianuro di sodio È un sale inorganico formato da un nazione di sodio+ e un cianide anione cn-. La sua formula chimica è NaCn. Noto anche come cianuro di sodio, è un solido cristallino bianco. È igroscopico, cioè assorbe l'acqua dall'ambiente e i suoi cristalli sono cubici come il NaCl del cloruro di sodio.
Quando si dissolve in acqua, tende a formare idrogeno cianuro di HCN. Le sue soluzioni dissolvono facilmente oro e argento. Questa funzione lo rende utilizzato per estrarre oro e argento dai suoi minerali. Le soluzioni utilizzate a questo scopo sono riciclate, cioè vengono riutilizzate più volte.
 Sodio sodio sodio cianuro. L26 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Sodio sodio sodio cianuro. L26 [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. Tuttavia, un po 'di cianuro riesce a sfuggire a alcuni stagni di rifiuti, il che rappresenta un pericolo per la fauna e l'essere umano, perché il cianuro è molto tossico e può causare la morte.
Il NACN viene utilizzato nell'industria chimica come intermediario per preparare diversi tipi di composti, come coloranti, sostanze chimiche per l'agricoltura e farmaci o farmaci.
Il cianuro di sodio è un composto molto pericoloso perché può causare la morte, quindi deve essere manipolato con estrema cautela.
[TOC]
Struttura
Il cianuro di sodio è formato da un ione Na+ e da un CN ionico-.
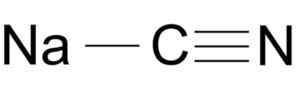 Struttura molecola di cianuro di sodio NACN. Arrowsmaster [dominio pubblico], fonte: Wikimedia Commons.
Struttura molecola di cianuro di sodio NACN. Arrowsmaster [dominio pubblico], fonte: Wikimedia Commons. Lo ione cianuro ha un'auto per auto e uno di azoto N United l'uno dall'altro da un triplo collegamento.
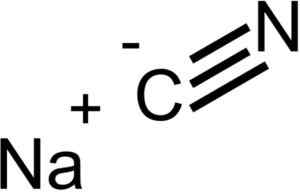 Ioni che compongono il cianuro di sodio nacn. EPOP [dominio pubblico]. Fonte: Wikimedia Commons.
Ioni che compongono il cianuro di sodio nacn. EPOP [dominio pubblico]. Fonte: Wikimedia Commons. Il NACN ha la stessa struttura cristallina del NaCl, quindi i suoi cristalli sono cubici.
Nomenclatura
-Cianuro di sodio
-Cianuro di sodio
Proprietà
Stato fisico
Solido cristallino bianco igroscopico (assorbire l'acqua dall'ambiente).
Peso molecolare
49.007 g/mol
Punto di fusione
563,7 ºC
Punto di ebollizione
1496 ºC
Punto d'infiammabilità
Non è infiammabile. Ma se è esposto a un incendio, si verificano ossidi di cianuro di idrogeno HCN e azoto.
Può servirti: sublimazione: concetto, processo ed esempiDensità
1.595 g/cm3 a 20 ºC
Solubilità
Molto solubile in acqua: 48 g/100 ml a 10 ° C, 82 g/100 ml a 35 ° C. Leggermente solubile in alcol
Costante di dissociazione
È idrolizzato in soluzione acquosa che genera HCN idrogeno cianuro. La costante di questa idrolisi è kH = 2,5 x 10-5.
ph
Le soluzioni acquose di Nacn sono fortemente alcaline
Proprietà chimiche
Quando si dissolve in acqua, si separa nei suoi ioni Na+ e cn-. In soluzione acquosa lo ione cianide cn- Prendi un protone H+ di acqua h2O formare HCN e uno ione oh-, Quindi la soluzione diventa alcalina.
Cn- + H2O → HCN + OH-
Per questo motivo, le loro soluzioni acquose si decompongono rapidamente rimanendo immagazzinati, formando idrogeno cianide HCN.
È corrosivo verso l'alluminio. Le sue soluzioni dissolvono facilmente l'AU e l'Ag Silver in presenza di aria.
È un agente chelante perché l'anione cianuro CN- Può unirsi facilmente ad altri metalli, come argento, oro, mercurio, zinco, cadmio, ecc.
Presenta un odore debole di mandorle amare.
Rischi
Deve essere gestito con molta attenzione. È un composto altamente velenoso, inibisce importanti processi metabolici e porta alla morte sia per ingestione, inalazione, assorbimento della pelle o contatto visivo.
Se il NACN viene inalato, si dissolve nella mucosa del tratto respiratorio e passa al flusso sanguigno. Lo ione cianuro di NaCn ha una forte affinità per il ferro in uno stato di ossidazione di +3, cioè la fede cationica ferrica3+.
Quando il cianuro viene assorbito, reagisce rapidamente con la fede3+ di un importante enzima dei mitocondri delle cellule (citocromo di ossidasi), impedendo che alcuni processi respiratori vengano eseguiti.
Pertanto, la respirazione cellulare è inibita o frenata ed è ipossia citotossica. Significa che cellule e tessuti non sono in grado di usare ossigeno, in particolare le cellule cerebrali e cardiache.
In questo modo si verifica un danno permanente o letale al corpo. Questo può accadere sia nell'uomo che negli animali.
Se la congestione dei vasi sanguigni e la corrosione della mucosa gastrica si ingervano, oltre a ciò che è già stato menzionato.
Può servirti: Justus von Liebig Il nacn di cianuro di sodio può causare la morte. Autore: Openicons. Fonte: Pixabay.
Il nacn di cianuro di sodio può causare la morte. Autore: Openicons. Fonte: Pixabay. Non è carburante, ma a contatto con gli acidi, rilascia HCN che è altamente infiammabile e tossico.
Se si scioglie con nitriti o clorati, può sfruttare.
Ottenimento
Può essere ottenuto con sodio NA, ammoniaca NH3 e carbone c. Il sodio reagisce con l'ammoniaca che dà sodio nanh2:
2 Na + 2 NH3 → 2 Nanh2 + H2↑
L'ammide del sodio viene riscaldata con carbonio a 600 ºC e produce cianamide di sodio NA2NCN, che quindi con carbone a 800 ° C diventa cianuro di sodio:
2 Nanh2 + C → 2 h2↑ + Na2Ncn
N / a2NCN + C → 2 NACN
Un altro metodo è sciogliere il cianammide di calcio e carbone C con navigatore di carbonato di sodio Na2Co3:
Cancn + C + Na2Co3 → Caco3 + 2 Nacn
Può anche essere preparato superando il gas di azoto n2 Per una miscela calda di carbonato di sodio2Co3 e carbone C in polvere, usando fede di fede come catalizzatore o acceleratore della reazione:
N / a2Co3 + 4 c + n2 → 2 NaCN + 3 CO ↑
Applicazioni
Nell'estrazione di minerali d'oro e d'argento. Conseguenze
Il cianuro di sodio è stato usato a lungo per estrarre i metalli oro e argento dai suoi minerali.
Il cianuro utilizzato nel processo è riciclato, ma qualcosa sfugge allo stagno di rifiuti insieme ai metalli pesanti non recuperati.
Uccelli, pipistrelli e altri animali che bevono da queste lagune con cianuro sono stati avvelenati.
Ci sono registrazioni di una diga della Romania che ha tenuto isolato uno stagno di rifiuti ed è stato danneggiato da un evento meteorologico.
Di conseguenza, tonnellate di cianuro furono rilasciate sul fiume Sasar e nei vicini sistemi di falde acquifere come il Lapus, Somes, i fiumi Tisza, che terminano nel Danubio.
Ciò ha causato una cascata di morti animali, o in altre parole, un disastro ecologico.
 Estrazione d'oro con cianuro in Nuova Zelanda intorno al 1918. Puoi vedere la quantità di acqua contaminata, che è stata dimessa nei fiumi vicini. National Library NZ sui Comuni [nessuna restrizione]. Fonte: Wikimedia Commons.
Estrazione d'oro con cianuro in Nuova Zelanda intorno al 1918. Puoi vedere la quantità di acqua contaminata, che è stata dimessa nei fiumi vicini. National Library NZ sui Comuni [nessuna restrizione]. Fonte: Wikimedia Commons. Nella produzione di altri composti chimici
Il NaCn di cianuro di sodio è usato nella sintesi di vari tipi di composti organici.
Può servirti: ossido di sodio (Na2o): struttura, formula, proprietà, rischiAd esempio, vengono preparati pigmenti e coloranti (compresi lucidi ottici), composti per l'uso in agricoltura o agrochimici e vari prodotti farmaceutici.
Serve anche per ottenere agenti chelanti o di rapimento di ioni metallici.
Con cianuro di sodio, vengono preparati i composti chiamati nitrili, che quando trattati con acido acido o soluzione acquosa alcalina consentono di ottenere acidi carbossilici.
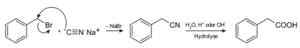 Preparazione di un acido carbossilico mediante nacn di cianuro di sodio. Roland Mattern [dominio pubblico]. Fonte: Wikimedia Commons.
Preparazione di un acido carbossilico mediante nacn di cianuro di sodio. Roland Mattern [dominio pubblico]. Fonte: Wikimedia Commons. Permette di preparare acidi grassi con gruppi ciano, cianuri di metalli pesanti e hcn di cianuro di idrogeno.
Nell'industria dei metalli
Il NACN viene utilizzato nelle soluzioni utilizzate in galvanoplastica o elettrodo metallico (rivestimento in metallo con altri) ad esempio zinco.
È un componente di acciaio indurito. Serve anche nella pulizia dei metalli.
In altri usi
Il cianuro di sodio è un intermediario nella produzione di nylon.
Viene utilizzato per separare i minerali mediante flottazione con schiuma.
Applicazioni fuori uso, interrogate o molto rare
La nazione veniva usata per eliminare i roditori, come conigli e ratti e le loro tane, e per porre fine ai nidi di termiti.
Attualmente è usato occasionalmente per eliminare coyote, volpi e cani selvatici. È usato sotto forma di capsule come dosi semplici o multiple in terre di pascolo, caccia e foreste.
A causa della sua estrema tossicità, il NACN deve essere usato solo dalle persone preparate.
Questo uso è considerato molto pericoloso per l'essere umano, ma ci sono quelli che lo usano ancora.
 La vita selvaggia non dovrebbe essere eliminata, poiché questi animali combattono già per sopravvivere in condizioni difficili. Autore: Maxwdhs. Fonte: Pixabay.
La vita selvaggia non dovrebbe essere eliminata, poiché questi animali combattono già per sopravvivere in condizioni difficili. Autore: Maxwdhs. Fonte: Pixabay. In agricoltura era precedentemente utilizzato per fumigare alberi di frutta di agrumi e altri frutti. È stato anche usato come insetticida e miticide (eliminatore dell'acaro) per essere applicato dopo la raccolta, per agrumi non piani o per la fumigazione dei camion usati per trasportarli. È stato anche usato per fumigare navi, vagoni ferroviari e magazzini.
Tutti questi usi sono stati messi in discussione dall'elevata tossicità del cianuro di sodio. Per questo motivo, non è più usato o solo molto raramente e in condizioni molto controllate.
Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Cianuro di sodio. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Kirk-Othmer (1994). Enciclopedia della tecnologia chimica. Quarta edizione. John Wiley & Sons.
- Hurst, h.E. e Martin, M.D. (2017). Tossicologia. Cianuro. In farmacologia e terapie per odontoiatria (settima edizione). Recuperato da ScienceDirect.com.
- Coppock, r.W. e dziwenka, m. (2015). Minacce alla fauna selvatica da parte degli agenti di guerra chimica. In Manuale di tossicologia degli agenti di guerra chimica (seconda edizione). Recuperato da ScienceDirect.com.
- Morrison, r.T. e boyd, r.N. (2002). Chimica organica. 6a edizione. Prentice-Hall.
- « Triossido di zolfo (SO3) Struttura, proprietà, rischi, usi
- Struttura di ossido di bario (BAO), proprietà, usi, rischi »

