Triossido di zolfo (SO3) Struttura, proprietà, rischi, usi
- 4728
- 1073
- Baldassarre Ross
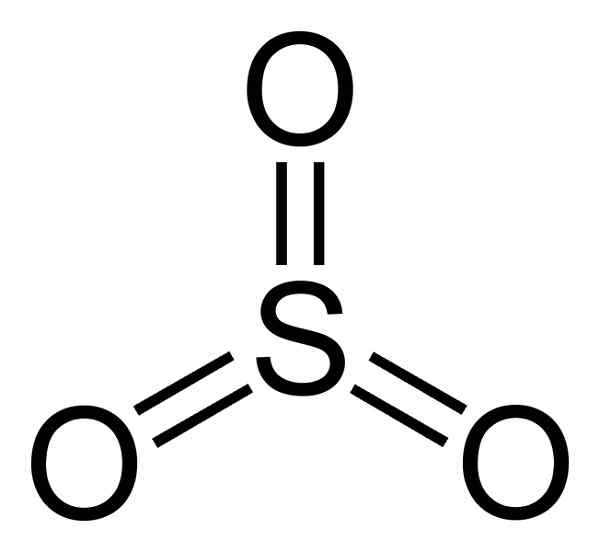
Lui Triossido di zolfo È un composto inorganico formato dall'unione di un atomo di zolfo (S) e 3 atomi di ossigeno (O). La sua formula molecolare è così3. A temperatura ambiente, il SO3 È un liquido che emette gas in aria.
La struttura del SO3 Gassoso è piatto e simmetrico. I tre ossigeno si trovano equamente attorno allo zolfo. Il SO3 Reagisce violentemente con l'acqua. La reazione è esotermica, il che significa che il calore viene prodotto, in altre parole, molto viene riscaldato.
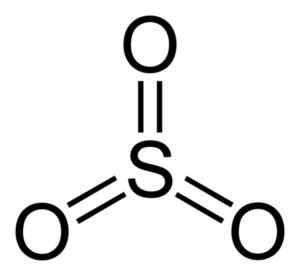 Molecola di triossido di zolfo così3. Autore: Benjah-BMM27. Fonte: Wikimedia Commons.
Molecola di triossido di zolfo così3. Autore: Benjah-BMM27. Fonte: Wikimedia Commons. Quando il SO3 Raffreddore liquido, diventa un solido che può avere tre tipi di struttura: alfa, beta e gamma. Il più stabile è l'alfa, sotto forma di strati insieme all'altro che costituiscono una rete.
Il triossido di zolfo gassoso viene utilizzato per preparare l'acido solforico di fumo, chiamato anche olio, a causa della sua somiglianza di olio o sostanza grassa. Un'altra delle sue applicazioni importanti è nella solfonazione di composti organici, cioè l'aggiunta di gruppi -so3- a questi. Pertanto, possono essere preparati prodotti chimici utili come detergenti, coloranti, pesticidi, tra molti altri.
Il SO3 È molto pericoloso, può causare gravi ustioni, occhi e danni della pelle. Né dovrebbe essere inalato o ingerito perché può causare la morte da ustioni interne, in bocca, esofago, stomaco, ecc.
Per questi motivi, deve essere manipolato con grande cautela. Non dovresti mai contattare acqua o materiali combustibili come legno, carta, tessuti, ecc., Bene, il fuoco può essere prodotto. Né dovrebbe essere scartato o fognario a causa del pericolo di esplosione.
Il SO3 Gaseous generato nei processi industriali non dovrebbe essere rilasciato nell'ambiente, poiché è uno dei responsabili della pioggia acida che ha già danneggiato le grandi estensioni delle foreste nel mondo.
[TOC]
Struttura
La molecola di triossido di zolfo così3 In stato gassoso ha una struttura triangolare piatta.
Ciò significa che sia lo zolfo che il tre ossigeno si trovano nello stesso piano. Inoltre, la distribuzione di ossigeno e tutti gli elettroni è simmetrica.
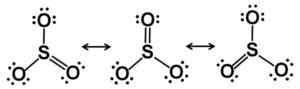 Starcutures di Lewis Resonance. Gli elettroni sono equamente distribuiti nel SO3. Autore: Marilú Stea.
Starcutures di Lewis Resonance. Gli elettroni sono equamente distribuiti nel SO3. Autore: Marilú Stea. In stato solido sono noti tre tipi di SO3: Alfa (α-così3), beta (β-so3) e gamma (γ-so3).
La forma gamma γ-so3 contiene trimmer ciclici, cioè tre unità di così3 insieme formando una molecola ciclica o ad anello.
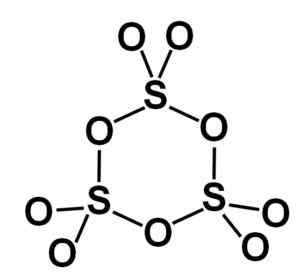 Molecola ad anello del tipo di triossido di zolfo solido gamma. Autore: Marilú Stea.
Molecola ad anello del tipo di triossido di zolfo solido gamma. Autore: Marilú Stea. La fase beta β-così3 Ha le catene elicoli infinite di composizione tetraedra così4 Unite l'uno con l'altro.
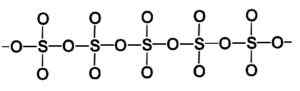 Struttura di un tipo beta di tipo triossido di zolfo solido. Autore: Marilú Stea.
Struttura di un tipo beta di tipo triossido di zolfo solido. Autore: Marilú Stea. Il modo più stabile è Alpha α-So3, Simile alla beta ma con una struttura a livello, con le catene unite che formano una rete.
Nomenclatura
-Triossido di zolfo
-Anidride solforica
-Ossido solforico
-SW3 Gamma, γ-so3
-SW3 beta, β-così3
-SW3 Alfa, α-so3
Proprietà fisiche
Stato fisico
A temperatura ambiente (circa 25 ºC) e pressione atmosferica, il SO3 È un liquido incolore che emette fumi in aria.
Quando il SO3 Il liquido è puro a 25 ºC è una miscela di SO3 Monomerico (una singola molecola) e trimerica (3 molecole legate) di Formula S3O9, Chiamato anche così3 Gamma γ-so3.
Può servirti: scala Rankine: cosa è, conversioni, esempiQuando si abbassa la temperatura, se SO3 È puro quando raggiunge i 16,86 ºC, si solidifica o si blocca γ-So3, Chiamato anche "So ghiaccio3".
Se contiene piccole quantità di umidità (anche tracce o quantità estremamente piccole) il SO3 Polimerizza la beta β-così3 che forma cristalli con una luminosità setosa.
Quindi si formano più sindacati generando la struttura α-così3, che è un solido cristallino sotto forma di aghi che ricorda l'amianto o l'amianto.
Quando il fusione alfa e beta genera gamma.
Peso molecolare
80,07 g/mol
Punto di fusione
SW3 Gamma = 16,86 ºC
Triplo punto
È la temperatura alla quale sono presenti i tre stati fisici: solido, liquido e gassoso. Nella forma alfa, il triplo punto è a 62,2 ºC e nella beta è a 32,5 ºC.
Riscaldando la forma alfa, questo ha una maggiore tendenza a sublimare che a sciogliere. Sublimimar significa spostarsi direttamente dallo stato solido al soda, senza attraversare lo stato liquido.
Punto di ebollizione
Tutte le forme di così3 Fai bollire a 44,8 ºC.
Densità
Il SO3 Il liquido (gamma) ha una densità di 1.9225 g/cm3 a 20 ºC.
Il SO3 Gassoso ha una densità di 2,76 rispetto all'aria (aria = 1), indicando che è più pesante dell'aria.
Pressione del vapore
SW3 Alfa = 73 mm Hg a 25 ºC
SW3 beta = 344 mm Hg a 25 ° C
SW3 Gamma = 433 mm Hg a 25 ºC
Ciò significa che la forma gamma tende a evaporare più facilmente della beta e questo che l'Alfa.
Stabilità
La forma alfa è la struttura più stabile, gli altri sono metastabili, cioè sono meno stabili.
Proprietà chimiche
Il SO3 reagisce energicamente con l'acqua per dare acido solforico H2SW4. Quando reagiscono c'è molto calore in modo che il vapore acqueo venga rapidamente distaccato dalla miscela.
Essere esposti all'aria di onda il SO3 assorbi rapidamente l'umidità, emettendo vapori densi.
È un agente molto forte disidratante, ciò significa che elimina facilmente l'acqua da altri materiali.
Lo zolfo del SO3 Ha un'affinità per elettroni liberi (cioè elettroni che non sono in un legame tra due atomi), quindi tende a formare complessi con composti che li possiedono come piridina, trimetilammina o diossano.
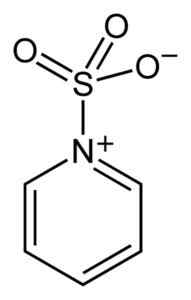 Complesso tra triossido di zolfo e piridina. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons.
Complesso tra triossido di zolfo e piridina. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons. Formando complessi, lo zolfo prende "preso in prestito" gli elettroni dell'altro composto per soddisfare la loro mancanza di questi. La triossido di zolfo è ancora disponibile in questi complessi, che vengono utilizzati nelle reazioni chimiche per fornirlo3.
È un potente reagente solfonante di composti organici, il che significa che serve ad aggiungere facilmente un gruppo3- Alle molecole.
Reagisce facilmente con gli ossidi di molti metalli per dare solfati di questi metalli.
È corrosivo verso metalli, tessuti animali e vegetali.
Il SO3 È un materiale difficile da gestire per diversi motivi: (1) il suo punto di ebollizione è relativamente basso, (2) ha la tendenza a formare polimeri solidi a temperature inferiori a 30 ºC e (3) ha un'alta reattività verso quasi tutte le sostanze organiche E l'acqua.
Può servirti: solidi amorfi: struttura, proprietà, esempiPuò polimerizzare esplosiva se non contiene uno stabilizzatore e c'è una presenza di umidità. Come stabilizzatori, vengono utilizzati dimetilsolfato o ossido di boro.
Ottenimento
È ottenuto dalla reazione a 400 ºC tra l'anidride solforosa così2 e ossigeno molecolare o2. Tuttavia, la reazione è molto lenta e sono necessari catalizzatori per aumentare la velocità di questo.
2 Quindi2 + O2 ⇔ 2 SO3
Tra i composti che accelerano questa reazione ci sono il Platino Metal Pt, il pentossido del vanadio V2O5, Ossido ferrico2O3 e ossido nitrico.
Applicazioni
Nella preparazione del petrolio
Una delle sue applicazioni principali consiste nella preparazione di olio o acido solforico di fumo, chiamata perché emette vapori visibili ad occhio nudo. Per ottenerlo, il SO viene assorbito3 In acido solforico concentrato H2SW4.
 PU -Sulfuric Oleum o fumi. Puoi vedere il fumo bianco uscire dalla bottiglia. W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
PU -Sulfuric Oleum o fumi. Puoi vedere il fumo bianco uscire dalla bottiglia. W. Oelen [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. Questo viene fatto in speciali torri in acciaio inossidabile in cui acido solforico concentrato (che è liquido)3 Gassoso sta salendo.
Liquido e gas entrano in contatto e si uniscono, formando l'oleo che è un aspetto oleoso liquido. Questo ha una miscela di H2SW4 E così3, ma ha anche molecole di acido disolfurico H2S2O7 e Trisulfuric h2S3O10.
Nelle reazioni di solfonazione chimica
La solfonazione è un processo chiave in applicazioni industriali su larga scala per la produzione di detergenti, tensioattivi, coloranti, pesticidi e prodotti farmaceutici.
Il SO3 Serve come agente solfonante per preparare oli sulfonati e detergenti alchil-angoli, tra molti altri composti. Di seguito è riportata la reazione di solfonazione di un composto aromatico:
Arh + so3 → Arso3H
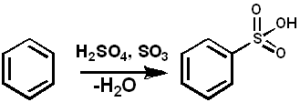 Benzene solfonazione con così3. PEDRO8410 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Benzene solfonazione con così3. PEDRO8410 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. Per le reazioni di solfonazione, è possibile utilizzare oleum3 nella forma dei suoi complessi con piridina o trimetilammina, tra gli altri.
Nell'estrazione del metallo
Gas s3 È stato usato nel trattamento dei minerali. Gli ossidi di metallo semplici possono diventare solfati molto più solubili quando li tratti con così3 a temperature relativamente basse.
Minerali di zolfo come pirite (solfuro di ferro), tratto3 Consente questi metalli facilmente e a basso costo.
Reagi di ferro, nichel e rame reagiscono con SO gas3 Anche a temperatura ambiente, formando i rispettivi solfati, che sono molto solubili e possono essere sottoposti ad altri processi per ottenere il metallo puro.
In diversi usi
Il SO3 Serve a preparare l'acido clorosulfurico chiamato anche acido clorosolfonico HSO3Cl.
Il triossido di zolfo è un ossidante molto potente ed è utilizzato nella produzione esplosiva.
Rischi
Alla salute
Il SO3 È un composto altamente tossico per tutte le rotte, cioè inalazione, ingestione e contatto con la pelle.
Irrita e corrode le mucose. Provoca pelle e occhi. I suoi vapori sono molto tossici quando vengono inalati. Vengono prodotte ustioni interne, difficoltà respiratoria, dolore toracico ed edema polmonare.
Può servirti: butanone: struttura, proprietà e usi Il triossido di zolfo SO3 è molto corrosivo e pericoloso. Autore: Openicons. Fonte: Pixabay.
Il triossido di zolfo SO3 è molto corrosivo e pericoloso. Autore: Openicons. Fonte: Pixabay. È velenoso. La sua ingestione genera gravi ustioni, esofago e stomaco. Inoltre, si sospetta che sia cancerogeno.
Fuoco o esplosione
Rappresenta il pericolo di incendio quando si entra in contatto con materiali organici come legno, fibre, carta, olio, cotone, soprattutto se sono bagnati.
C'è anche rischio se si entra in contatto con le basi o se riduce gli agenti. È combinato con l'acqua in modo esplosivo, formando acido solforico.
Il contatto con i metalli può produrre idrogeno gas h2 che è molto infiammabile.
Dovrebbe essere evitato nei vasi di vetro per prevenire una possibile rottura violenta del contenitore.
Impatto ambientale
Il SO3 È considerato uno dei più grandi inquinanti presenti nell'atmosfera terrestre. Ciò è dovuto al suo ruolo nella formazione di aerosol e al suo contributo alla pioggia acida (a causa della formazione di acido solforico H2SW4).
 Foresta danneggiata dalla pioggia acida nella Repubblica Ceca. Lovecz [dominio pubblico]. Fonte: Wikimedia Commons.
Foresta danneggiata dalla pioggia acida nella Repubblica Ceca. Lovecz [dominio pubblico]. Fonte: Wikimedia Commons. Il SO3 Si forma nell'atmosfera a causa dell'ossidazione dell'anidride solforosa così2. Quando si forma il SO3 Questo reagisce rapidamente con l'acqua per formare acido solforico H2SW4. Secondo studi recenti, ci sono altri meccanismi di trasformazione SOS3 Nell'atmosfera, ma a causa della grande quantità di acqua presente in questo, il SO è ancora considerato3 Principalmente convertito in h2SW4.
Il SO3 rifiuti gassosi di gas o industriale che contiene non dovrebbero essere scaricati nell'atmosfera perché è un contaminante pericoloso. È un gas estremamente reattivo e, come è già stato detto sopra, in presenza di umidità dell'aria3 Diventa acido solforico h2SW4. Pertanto, nell'aria il SO3 persiste sotto forma di acido solforico che formano piccole goccioline o aerosol.
Se le goccioline di acido solforico entrano nel tratto respiratorio degli animali o degli animali, crescono rapidamente a causa dell'umidità presente lì, quindi hanno la possibilità di penetrare nei polmoni. Uno dei meccanismi della nebbia acida di H2SW4 (È così3) Può produrre una forte tossicità è perché il pH extracellulare e intracellulare degli organismi viventi (piante, animali e essere umani) cambiamenti cambiamenti).
Secondo alcuni ricercatori, così nebbia3 È la causa dell'aumento degli asmatici in un'area del Giappone. La nebbia di così3 Ha un effetto molto corrosivo sui metalli, quindi le strutture metalliche costruite dall'essere umano come alcuni ponti e costruzioni possono essere molto colpite.
Il SO3 Il liquido non deve essere scartato nel drenaggio di acque sporche o fogne. Se viene versato nelle fogne, puoi creare pericolo di fuoco o esplosione. Se viene versato per caso, un flusso d'acqua non deve essere diretto verso il prodotto. Non dovrebbe mai essere assorbito in segatura o altro combustibile assorbente, in quanto può generare fuochi.
Dovrebbe essere assorbito in sabbia asciutta, terra asciutta o altro assorbente inerte totalmente asciutto. Il SO3 Non dovrebbe essere riversato nell'ambiente e non dovrebbe mai mettersi in contatto con questo. Dovrebbe essere tenuto lontano dalle fonti d'acqua perché con ciò produce acido solforico dannoso per gli organismi acquatici e terrestri.
Riferimenti
- Sarkar, s. et al. (2019). Influenza dell'ammoniaca e dell'acqua sul destino del triossido di zolfo nella troposfera: ricerca teorica di percorsi di formazione di acido solfamico e acido solforico. J Phys Chem A.2019; 123 (14): 3131-3141. NCBI recuperato.Nlm.NIH.Gov.
- Muller, t.L. (2006). Acido solforico e triossido di zolfo. Kirk-Othmer Enciclopedia della tecnologia chimica. Volume 23. Estratto dalla biblioteca online.Wiley.com.
- O.S. Biblioteca nazionale di medicina. (2019). Triossido Sulphur. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Kikuchi, r. (2001). Gestione ambientale dell'imissione del triossido di zolfo: impatto di SO3 Sulla salute umana. Management ambientale (2001) 27: 837. Link recuperato.Springer.com.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Ismail, m.Yo. (1979). Estrazione di metalli da solfuri mediante triossido di zolfo nel letto fluidizzato. J. Chimica. Tecnologia. Biotecnolo. 1979, 29, 361-366. Estratto dalla biblioteca online.Wiley.com.
- « Geografia del Malawi Lago, geologia, importanza, fauna, rios
- Struttura, proprietà, rischi, usi, usi, usi, usi, usi del sodio »

