Proprietà, usi, strutture, rischi, rischi, rischi, rischi

- 4528
- 870
- Dott. Rodolfo Gatti
Lui Cianuro di potassio È un composto inorganico formato da un potassio ionico K+ e uno ione CN cianuro-. La sua formula chimica è KCN. È un solido bianco cristallino, estremamente velenoso.
Il KCN è molto solubile in acqua e quando si dissolve viene idrolizzato che forma acido cianidrico o idrogeno cianuro HCN, che è anche molto velenoso. Il cianuro di potassio può formare sali composti con oro e argento, quindi è stato usato per estrarre questi metalli preziosi da alcuni minerali.
 Cianuro di potassio solido kcn. Morienus (Caricato da DE: Benutzer: Bxxxd da: Wiki) [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]]. Fonte: Wikimedia Commons.
Cianuro di potassio solido kcn. Morienus (Caricato da DE: Benutzer: Bxxxd da: Wiki) [CC BY-SA 3.0 (http: // creativeCommons.Org/licenze/by-sa/3.0/]]. Fonte: Wikimedia Commons. Il KCN viene utilizzato per coprire metalli economici con oro e argento attraverso un processo elettrochimico, ovvero un metodo in cui una corrente elettrica viene passata attraverso una soluzione che contiene un sale composto da metallo prezioso, cianuro e potassio.
Cianuro di potassio perché contiene cianuro deve essere manipolato con grande cautela, con attrezzi adeguati. Non dovrebbe mai essere scartato nell'ambiente, perché è anche molto tossico per la maggior parte degli animali e delle piante.
Tuttavia, i metodi che utilizzano alghe comuni vengono studiati per rimuovere il cianuro di potassio dell'acqua contaminata con basse concentrazioni di questo.
[TOC]
Struttura
KCN è un composto ionico formato da un catione di potassio k+ e un cianide anione cn-. In questo l'atomo di carbonio è collegato all'atomo di azoto attraverso un triplo legame covalente.
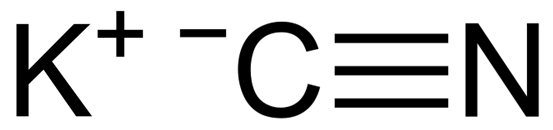 Struttura chimica del cianuro di potassio KCN. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Struttura chimica del cianuro di potassio KCN. Capacio [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. Nel cianuro di potassio solido l'anione CN- Può ruotare liberamente da ciò che si comporta come un anione sferico, di conseguenza il cristallo KCN ha una struttura cubica simile a quella del cloruro di potassio KCL.
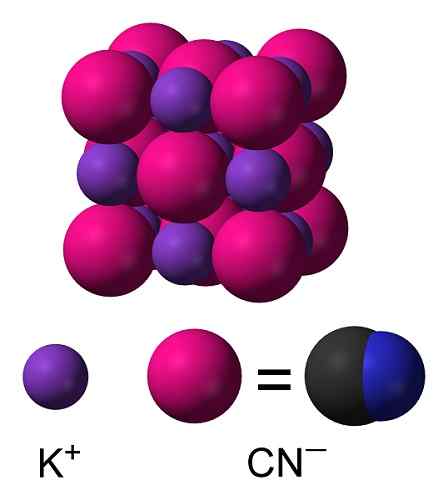 Struttura cristallina KCN. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons.
Struttura cristallina KCN. Benjah-BMM27 [dominio pubblico]. Fonte: Wikimedia Commons. Nomenclatura
- Cianuro di potassio
- Cianuro di potassio
- Cianopotasio
Proprietà
Stato fisico
Solido cristallino bianco. Cristalli cubici.
Peso molecolare
65.116 g/mol.
Punto di fusione
634,5 ° C
Può servirti: solfato di alluminio (AL2 (SO4) 3)Punto di ebollizione
1625 ° C.
Densità
1,55 g/cm3 a 20 ° C.
Solubilità
Molto solubile in acqua: 716 g/L a 25 ° C e 100 g/100 ml di acqua a 80 ° C. Piccolo solubile in metanolo: 4,91 g/100 g di metanolo a 19,5 ° C. Pochissimo solubile in etanolo: 0,57 g/100 g di etanolo a 19,5 ° C.
ph
Una soluzione acquosa di 6,5 g di kcn in 1 l di acqua ha un pH di 11,0.
Costante di idrolisi
KCN è molto solubile in acqua. Quando lo ione cianide CN è gratuito- che richiede un protone H+ di acqua per formare acido cianodrico HCN e rilasciare uno ione OH-:
Cn- + H2O → HCN + OH-
La costante di idrolisi indica la tendenza con cui viene eseguita detta reazione.
KH = 2,54 x 10-5
Le soluzioni acquose KCN rilasciano l'ambiente HCN Hydrogen cianuro quando si riscaldano 80 ° C.
Proprietà chimiche
Non è infiammabile, ma quando il KCN solido viene riscaldato fino a quando la sua decomposizione emette idrogeno cianuro di HCN molto tossico, gli ossidi di azoto non lo faX, K -potassio ossido2O e monossido di carbonio.
Il KCN reagisce con sali d'oro che formano potassio aurocianuro kau (CN)2 e potassio auricianuro kau (CN)4. Questi sono complessi sali incolori. Con l'Ag Silver Metal AG, il KCN forma il potassio argentocianide KAG (CN)2.
Lo ione KCN cianuro reagisce con alcuni composti organici che hanno alogeno (come cloro o bromo) e occupa il luogo di questi. Ad esempio, reagisce con l'acido bromoacetico per dare acido cianoacetico.
Altre proprietà
È igroscopico, assorbe l'umidità dell'ambiente.
Ha un odore morbido di mandorle amare, ma questo non è rilevato da tutte le persone.
Ottenimento
Il KCN è preparato dalla reazione di idrossido di potassio KOH in soluzione acquosa con idrogeno cianide HCN. Il ferrocianuro di potassio K è anche ottenuto dal riscaldamento4Faith (CN)6:
K4Faith (CN)6 → 4 kcn + 2 c + n2↑ + Faith
Utilizzare nell'elettrodo metallico
Viene utilizzato nel processo di coprire piccoli metalli preziosi con oro e argento. È un processo elettrolitico, cioè l'elettricità viene passata attraverso una soluzione acquosa con sali appropriati.
Può servirti: Triossido di zolfo (SO3): struttura, proprietà, rischi, usiArgento
Viene utilizzato il potassio argentocianide kag (CN)2 Al rivestimento con metalli più economici (AG).
Questi sono collocati in una soluzione acquosa di kag di potassio (CN)2, Dove l'anodo o il palo positivo è una barra d'argento pura (AG) e il catodo o il polo negativo è il metallo economico che desidera ricoprire l'argento.
Mentre una corrente elettrica passa attraverso la soluzione, l'argento viene depositato sull'altro metallo. Quando vengono utilizzati sali di cianuro, lo strato d'argento viene depositato in modo più fine, più compatto e aderente rispetto alle soluzioni di altri composti.
 Alcuni articoli di gioielli sono coperti di argento usando sali KCN. Autore: Stocksnap. Fonte: Pixabay.
Alcuni articoli di gioielli sono coperti di argento usando sali KCN. Autore: Stocksnap. Fonte: Pixabay. Oro
Analogamente nel caso dell'oro (AU), l'aurocianuro di potassio Kau (CN)2 e potassio auricianuro kau (CN)4 Altri metalli vengono utilizzati per marrone elettroliticamente.
 Connettori elettrici rivestiti in oro che probabilmente utilizzano sali KCN. CJP24 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Connettori elettrici rivestiti in oro che probabilmente utilizzano sali KCN. CJP24 [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. Altri usi
Alcuni altri usi del cianuro di potassio sono menzionati di seguito.
- Per il processo industriale di indurimento dell'acciaio di nitrorazione (aggiunta di azoto).
- Per pulizia in metallo.
- Nei processi di stampa e fotografia.
- In precedenza è stato usato per l'estrazione di oro e argento dai minerali che li contengono, ma poi è stato sostituito dal cianuro di nacn di sodio che è meno costoso, sebbene ugualmente tossico.
- Come insetticida per la fumigazione di alberi, navi, auto ferroviarie e magazzini.
- Come reagente in chimica analitica, cioè fare analisi chimiche.
- Per preparare altri composti chimici, come coloranti e coloranti.
 Estrazione dell'oro in Sudafrica nel 1903 usando KCN quello che era nell'inquinamento mortale dell'ambiente circostante. Argyll, John Douglas Sutherland Campbell, duca di, 1845-1914; Creswicke, Louis [nessuna restrizione]. Fonte: Wikimedia Commons.
Estrazione dell'oro in Sudafrica nel 1903 usando KCN quello che era nell'inquinamento mortale dell'ambiente circostante. Argyll, John Douglas Sutherland Campbell, duca di, 1845-1914; Creswicke, Louis [nessuna restrizione]. Fonte: Wikimedia Commons. Rischi
KCN è un composto molto velenoso per gli animali e la maggior parte delle piante e dei microrganismi. È classificato come super tossico. È ancora letale in quantità molto piccole.
Può servirti: cloruro di nichel (NICL2): struttura, proprietà, ottenimento, usiIl suo effetto dannoso può verificarsi per inalazione, contatto con la pelle o gli occhi o l'ingestione. Inibisce molti processi metabolici, in particolare le proteine del sangue che partecipano al trasporto di ossigeno come l'emoglobina.
Colpisce gli organi o i sistemi più sensibili alla mancanza di ossigeno, come il sistema nervoso centrale (cervello), il sistema cardiovascolare (vasi cardiaci e sanguigni) e polmoni.
 Il cianuro di potassio è un veleno. Autore: clker-free-vector-images. Fonte: Pixabay.
Il cianuro di potassio è un veleno. Autore: clker-free-vector-images. Fonte: Pixabay. Meccanismo di azione
KCN interferisce con la capacità del corpo di usare l'ossigeno.
Lo ione cian cn- del KCN ha una grande affinità per la fede ferrica3+, Il che significa che quando il cianuro lo assorbe reagisce rapidamente con la fede3+ Sangue e tessuti.
In questo modo impedisce il respiro delle cellule, che entrano in uno stato di mancanza di ossigeno, perché sebbene provano a respirare non possono usarlo.
Si verifica quindi uno stato transitorio di hipperapnea (sospensione del respiro) e mal di testa, e infine la morte per arresto respiratorio.
Rischi aggiuntivi
Durante il riscaldamento produce gas molto tossici come HCN, ossidi di azotoX, K -potassio ossido2O e monossido di carbonio.
Al contatto con l'umidità HCN che è altamente infiammabile e molto tossica.
KCN è anche molto velenoso per gli organismi acquatici. Non dovrebbe mai essere scartato nell'ambiente, poiché può verificarsi l'inquinamento dell'acqua in cui bevono animali e abitano i pesci.
Tuttavia, ci sono batteri che producono cianuro come Chromobacterium violaceum e alcune specie di Pseudomonas.
Studi recenti
Alcuni ricercatori hanno scoperto che le alghe verdi Chlorella vulgaris Può essere usato per trattare le acque contaminate con cianuro di potassio KCN a basse concentrazioni.
Le alghe sono state in grado di rimuovere in modo efficiente il KCN, perché questo in basse quantità ha stimolato la crescita delle alghe poiché ha attivato un meccanismo interno per resistere alla tossicità del KCN.
Ciò significa che le alghe Chlorella vulgaris Ha il potenziale per rimuovere il cianuro e che un metodo efficace per il trattamento biologico della contaminazione del cianuro potrebbe essere progettato con questo.
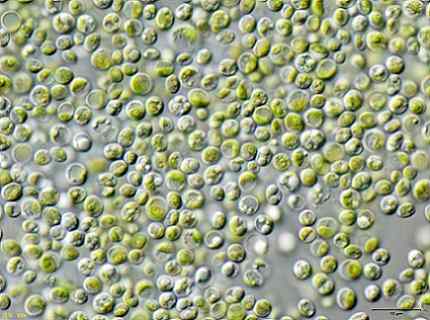 Immagine di alghe Chlorella vulgaris osservato al microscopio. JA: Utente: Neon / Utente: Neon_JA [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Immagine di alghe Chlorella vulgaris osservato al microscopio. JA: Utente: Neon / Utente: Neon_JA [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. Riferimenti
- O.S. Biblioteca nazionale di medicina. (2019). Cianuro di potassio. Centro nazionale per le informazioni sulla biotecnologia. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Coppock, r.W. (2009). Minacce alla fauna selvatica da parte degli agenti di guerra chimica. Nel manuale di tossicologia degli agenti di guerra chimica. Recuperato da ScienceDirect.com.
- Liu, q. (2017). Valutazione della rimozione dal cianuro di potassio e della sua tossicità nelle alghe verdi (Chlorella vulgaris). Toro ambiente contam tossicolo. 2018; 100 (2): 228-233. NCBI recuperato.Nlm.NIH.Gov.
- Il National Institute for Occupational Safety and Health (NIOSH). (2011). Cianuro di potassio: agente sistemico. CDC recuperato.Gov.
- Alvarado, l.J. et al. (2014). Riboswitch Discovery, struttura e funzione. Sintesi di uracile. In metodi in enzimologia. Recuperato da ScienceDirect.com.
- « Struttura, Proprietà, Usi, Impatto, Impatto, Impatto, Impatto, Impatto, Impatto, Impatto, Impatto di sodio
- Perché ho molto sonno? 9 cause e soluzioni »

