Struttura, Proprietà, Usi, Impatto, Impatto, Impatto, Impatto, Impatto, Impatto, Impatto, Impatto di sodio
- 1872
- 508
- Enzo De Angelis
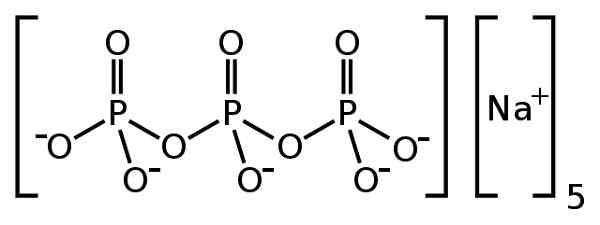
Lui sodio tripolifosfato È un composto inorganico formato da cinque ioni Na di sodio+ e un tripolifosfato p ione p3O105-. La sua formula chimica è Na5P3O10. Lo ione tripolifosfato contiene tre unità di fosfato collegate tra loro ed è quello che viene chiamato fosfato condensato.
L'anione tripolifosfato P3O105- Ha la capacità di catturare ioni come CA CALCIO2+ E Magnesio Mg2+, Pertanto, tripoliff di sodio.
 Sodio na tripolifosfato5P3O10. Benrr101 [dominio pubblico]. Fonte: Wikimedia Commons.
Sodio na tripolifosfato5P3O10. Benrr101 [dominio pubblico]. Fonte: Wikimedia Commons. Il sodio tripolifosfato è anche usato come fonte di fosforo nell'alimentazione di animali al pascolo e nel trattamento di alcuni disturbi di altri tipi di animali. Serve anche ad addensare e dare consistenza ad alcuni alimenti trasformati come creme, pudies e formaggi.
Nell'industria agricola viene utilizzato nei fertilizzanti nei granuli per impedire loro di attaccarsi l'uno all'altro e possono rimanere sciolti.
Sebbene ci siano state discussioni sull'impatto ambientale del tripolifosfato di sodio che viene aggiunto ai detergenti, attualmente si stima che non contribuisca sensibilmente a danneggiare l'ambiente, almeno attraverso i detergenti.
[TOC]
Struttura chimica
Sodio tripolifosfato fa parte dei fosfati condensati così chiamati perché sono diverse unità fosfato tra loro. In questo caso, lo ione tripolifosfato è un fosfato di condensa lineare perché ha una struttura di tipo a catena lineare, con legami fosforo-ossigeno-fosforo (P-O-P) (P-O-P).
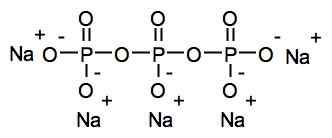 Struttura chimica del sodio tripolifosfato. Roland.Chem [GFDL (http: // www.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons.
Struttura chimica del sodio tripolifosfato. Roland.Chem [GFDL (http: // www.gnu.Org/copyleft/fdl.html)]. Fonte: Wikimedia Commons. Nomenclatura
- Sodio tripolifosfato
- Sodio trifosfato
- Pentasodio trifosfato
- STPP (acronimo inglese Tripolifato di sodio)
Proprietà
Stato fisico
Solido bianco cristallino.
Peso molecolare
367,86 g/mol.
Punto di fusione
622 ° C.
Densità
2,52 g/cm3
Solubilità
Acqua Solubile: 20 g/100 ml a 25 ° C e 86,5 g/100 ml a 100 ° C.
Può servirti: quali sono le funzioni chimiche inorganiche?ph
Una soluzione all'1% di tripolifosfato di sodio ha un pH di 9,7-9,8.
Proprietà chimiche
È un agente di rapimento di ioni, cioè può catturare gli ioni e stare insieme a loro. Forma complessa con molti metalli.
Se una soluzione di tripolifosfato di sodio viene riscaldata per lungo tempo, tende a diventare ortofosfato di sodio3Po4.
Altre proprietà
È leggermente igroscopico. Forma di idrati stabili, cioè composti che hanno molecole d'acqua (senza aver reagito con questo) di formula Na5P3O10.NH2O dove n può valere tra 1 e 6.
Secondo alcune fonti, una quantità di 20 mg di sodio tripolifosfato in un litro d'acqua non influisce sull'odore, il sapore o il pH di detta acqua.
Ottenimento
Il tripolifosfato di sodio viene preparato mediante disidratazione di ortofosfati (come il fosfato monosodico NAH2Po4 E dis -phfosphat na2HPO4) a temperature molto elevate (300-1200 ° C):
Nah2Po4 + 2 na2HPO4 → Na5P3O10 + 2 h2O
Può anche essere ottenuto mediante calcinazione controllata (significa riscaldamento a temperatura molto alta) di sodio ortofosfato Na3Po4 Con navigatore di carbonato di sodio2Co3 e acido fosforico H3Po4.
Applicazioni
Nei detergenti
Sodio tripolifosfato ha la proprietà di formare composti con determinati ioni, mantenendoli. Ha anche disperdendo proprietà di particelle sporche e le mantiene in sospensione.
Per questo motivo, è ampiamente utilizzato nelle formulazioni di detergenti per catturare e immobilizzare gli ioni di calcio Ca2+ e Magnesio Mg2+ di acqua (delle acque così dure così chiamate) e per mantenere sospeso lo sporco in acqua.
Gli ioni di cui sopra interferiscono con l'azione di pulizia. Catturandoli il tripolifosfato impedisce a tali ioni di precipitare insieme all'agente di pulizia o di attaccarsi dallo sporco nel tessuto impedendo alla macchia di decollare da questo.
Si dice in questo caso che il tripolifosfato di sodio "ammorbidisce l'acqua. Pertanto, viene utilizzato in detergenti per abbigliamento e detergenti automatici di lavastoviglie.
Può servirti: siringa PascalPoiché forma idrati stabili, i detergenti che lo possiedono nella loro formulazione possono essere immediatamente essiccati dallo spray (rugiada molto fine) che formano polveri secche.
 Polvere detergente che può contenere sodio tripolifosfato. Autore: Frank Habel. Fonte: Pixabay.
Polvere detergente che può contenere sodio tripolifosfato. Autore: Frank Habel. Fonte: Pixabay. Per uso veterinario
Il tripolifosfato di sodio viene utilizzato come integratore in soluzioni liquide come fonte di fosforo per il bestiame.
 L'alimentazione a vuoto può essere integrato con sodio tripolifosfato come sorgente di fosforo. Autore: Herney Gómez. Fonte: Pixabay.
L'alimentazione a vuoto può essere integrato con sodio tripolifosfato come sorgente di fosforo. Autore: Herney Gómez. Fonte: Pixabay. Serve anche a prevenire i calcoli renali nei gatti, per i quali questi animali vengono forniti per via orale. Tuttavia, dovrebbe essere prestata attenzione in dose in quanto può causare diarrea.
 Il tripolifosfato di sodio a dosi molto basse può prevenire i reni nei gatti. Autore: Scott Payne. Fonte: Pixabay.
Il tripolifosfato di sodio a dosi molto basse può prevenire i reni nei gatti. Autore: Scott Payne. Fonte: Pixabay. In medicina
Il tripolifosfato di sodio è stato utilizzato nella preparazione di nanoparticelle per il trasporto adeguato e il rilascio di farmaci chemioterapici al cancro. È stato anche usato nelle nanoparticelle per il trattamento delle infezioni dei funghi nei polmoni.
 Il tripolifosfato viene testato nella preparazione di nanofarmacali per curare le infezioni fungine nei polmoni. Autore: vettori di OpenClipart. Fonte: Pixabay.
Il tripolifosfato viene testato nella preparazione di nanofarmacali per curare le infezioni fungine nei polmoni. Autore: vettori di OpenClipart. Fonte: Pixabay. Nell'industria alimentare
Viene utilizzato in prodotti lattiero -caseari come podi, panna montata, panna acida e formaggio.
 Il creatore acido può contenere tripoliffing di sodio per migliorare la sua consistenza. Autore: Welikodub. Fonte: Pixabay.
Il creatore acido può contenere tripoliffing di sodio per migliorare la sua consistenza. Autore: Welikodub. Fonte: Pixabay. In altri alimenti viene usato come rapitore ionico, per dare consistenza, come addensante e come conservante.
Altri usi
- Come stabilizzatore dei perossidi
- Nei fluidi di perforazione petrolifera funziona come emulsionante e disperdente per controllare la viscosità del fango.
Può servirti: metalli ferrosi- In agricoltura, viene utilizzato come agente anti -gravidanza di alcuni fertilizzanti o prodotti agricoli, ciò significa che impediscono loro di aderire tra loro e i fertilizzanti possono essere facilmente distribuiti. È anche usato nelle formule di pesticidi applicate alle colture in crescita.
 Fabbrica di fertilizzanti. A volte Tripoliff di sodio sodio. Van Twin [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons.
Fabbrica di fertilizzanti. A volte Tripoliff di sodio sodio. Van Twin [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]. Fonte: Wikimedia Commons. Impatto ambientale
L'uso di prodotti con fosfati è stato identificato come uno dei collaboratori dell'eutrofizzazione delle acque sul pianeta.
L'eutrofizzazione è la crescita esagerata e accelerata di alghe e specie delle piante acquatiche che portano a una forte diminuzione dell'ossigeno disponibile in acqua, portando alla distruzione dell'ecosistema interessato (morte della maggior parte delle specie animali in esso).
 L'eutroficazione è la crescita esagerata di alghe in un lago, fiume o mare. F. Lamiot (proprio lavoro) [CC BY-SA 2.5 (https: // creativeCommons.Org/licenze/by-sa/2.5)]. Fonte: Wikimedia Commons.
L'eutroficazione è la crescita esagerata di alghe in un lago, fiume o mare. F. Lamiot (proprio lavoro) [CC BY-SA 2.5 (https: // creativeCommons.Org/licenze/by-sa/2.5)]. Fonte: Wikimedia Commons. Negli anni '80, la controversia sorse che l'uso di treesolifosfato di sodio nei detergenti stava contribuendo all'eutrofizzazione.
Oggi è noto che limita l'uso di detergenti con Tripoliff di sodio.
In effetti ci sono paesi che considerano il trenifosfato di sodio come una componente ecologica dei detergenti e promuovono il loro uso.
Rischi
Il tripolifosfato di sodio è la pelle e gli occhi irritanti. Il contatto visivo può causare danni a questi. Il contatto prolungato della pelle può produrre dermatite.
Se ingerito in grandi quantità, può causare nausea, vomito e diarrea, generando anche una grave riduzione dello ione di calcio nel sangue. Negli animali ha causato una riduzione del calcio delle ossa.
È considerato un composto sicuro ogni volta che vengono seguiti gli standard di produzione del prodotto in cui viene utilizzato.
Riferimenti
- Liu, e. E Chen, J. (2014). Ciclo di fosforo. Modulo di riferimento nei sistemi terrestri e nelle scienze ambientali. Enciclopedia di ecologia (seconda edizione). Vol. 4, 2014, pp.181-191. Recuperato da ScienceDirect.com
- O.S. Biblioteca nazionale di medicina. (2019). Tripolifato di sodio. Centro nazionale per le informazioni sulla biotecnologia. Recuperato da Pubchem.NCBI.Nlm.NIH.Gov.
- Mukherjee, b. et al. (2017). Somministrazione polmonare di nanocarrier drogati biodegradabili per un trattamento più efficace delle infezioni fungine nei polmoni: approfondimenti basati su recenti risultati. Nei sistemi multifunzionali per consegna combinata, biosensing e diagnostica. Recuperato da ScienceDirect.com.
- Kirk-Othmer. (1991). Enciclopedia della tecnologia chimica. 4th New York, John Wiley e Sons.
- Burckett st. Laurent, j. et al. (2007). Pulizia del lavanderia di tessuti. Nel manuale per la pulizia/decontaminazione delle superfici. Recuperato da ScienceDirect.com.
- Budavari, s. (Editore). (millenovecentonovantasei). L'indice Merck. NJ: Merck e Co., INC.
- Salahuddin, n. e galal, a. (2017). Migliorare la consegna di farmaci chemioterapici mediante strumenti di nanoprecisione. Nelle nanruzioni per la terapia del cancro. Recuperato da ScienceDirect.com.
- « Struttura di ossalato di sodio (Na2c2o4), proprietà, usi, rischi
- Proprietà, usi, strutture, rischi, rischi, rischi, rischi »

