Carbonato di ammonio ((NH4) 2CO3)
- 3588
- 758
- Benedetta Rinaldi
Cos'è il carbonato di ammonio?
Lui Carbonato di ammonio È un sale di azoto inorganico, in particolare ammoniaco, la cui formula chimica è (NH4)2Co3. È elaborato con metodi di sintesi, tra cui vale la pena usare la sublimazione di una miscela di solfato di ammonio e carbonato di calcio: (NH4)2SW4(S)+ Caco3(s) => (NH4)2Co3(s)+ caso4(S).
Generalmente, i sali di ammonio e il carbonato di calcio sono riscaldati in un contenitore per causare carbonato di ammonio. Il metodo industriale che produce tonnellate di questo sale è passare l'anidride carbonica attraverso una colonna di assorbimento che contiene una soluzione di ammonio in acqua, quindi eseguendo una distillazione.
I vapori contenenti ammonio, anidride carbonica e acqua sono condensati per formare cristalli di carbonato di ammonio: 2nh3(g)+ H2O (l) + co2(g) → (NH4)2Co3(S). Nella reazione si verifica l'acido carbonico, h2Co3, Dopo aver dissoluto l'anidride carbonica nell'acqua, ed è questo acido che produce i suoi due protoni, h+, a due molecole di ammoniaca.
Proprietà carbonatiche di ammonio
 Aspetto del carbonato di ammonio
Aspetto del carbonato di ammonio È un solido bianco, cristallino e incolore, con odori forti e sapori di ammoniaca. Si scioglie a 58 °.
Tuttavia, questa decomposizione si verifica in due passaggi: prima viene rilasciata una molecola NH3, Produzione di bicarbonato di ammonio (NH4HCO3); E in secondo luogo, se il riscaldamento continua, il carbonato è sproporzione.
È un solido solubile in acqua e meno solubile negli alcoli. Formare ponti idrogeno con acqua e quando 5 grammi si dissolvono in 100 grammi di acqua, genera una soluzione di base con un pH intorno a 8,6.
Può servirti: emulsionante: processo di emulsione, aspetti molecolari, applicazioniLa sua alta affinità per l'acqua è realizzata da un solido igroscopico (assorbe l'umidità), ed è per questo che è difficile trovarla nella sua forma anidrida. In effetti, la sua forma monoidrata, (NH4)2Co3· H2O), è il più comune di tutti e spiega come il sale sia un vettore di gas ammoniaca, causando odore.
Nell'aria si rompe per generare bicarbonato di ammonio e carbonato di ammonio (NH4NH2Co2).
Struttura chimica
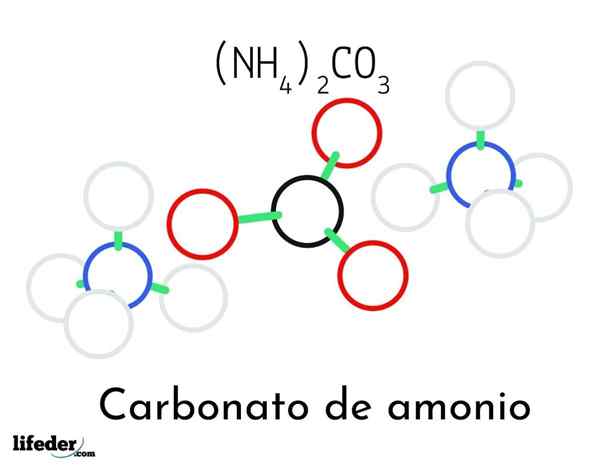
 Modello di struttura del carbonato di ammonio; Due cationi di ammonio e un carbonato
Modello di struttura del carbonato di ammonio; Due cationi di ammonio e un carbonato Nell'immagine superiore è illustrata la struttura chimica del carbonato di ammonio. Nel mezzo c'è l'anione co32-, il triangolo piatto con il centro nero e le sfere rosse; E ai suoi due lati, i cationi Ammonios NH4+ con geometrie tetraedriche.
La geometria ionica di ammonio è spiegata dall'ibridazione SP3 dell'atomo di azoto, ordinando gli atomi di idrogeno (le sfere bianche) attorno a forma di tetraedro. Tra i tre ioni sono stabiliti da ponti idrogeno (H3N-h- o-co22-).
Grazie alla sua geometria, una singola co -anion32- può formare fino a tre ponti idrogeno; mentre i cationi NH4+ Forse non possono formare i loro corrispondenti quattro ponti idrogeno a causa delle repulsioni elettrostatiche tra le loro cariche positive.
Il risultato di tutte queste interazioni è la cristallizzazione di un sistema ortorrombico. Perché è così igroscopico e solubile in acqua? La risposta è nello stesso paragrafo precedente: Bridges idrogeno.
Queste interazioni sono responsabili del rapido assorbimento d'acqua del sale anidridico da formare (NH4)2Co3· H2O). Ciò si traduce in cambiamenti nella disposizione spaziale degli ioni e quindi, nella struttura cristallina.
Può servirti: cloruro di nichel (NICL2): struttura, proprietà, ottenimento, usiCuriosità strutturali
Non importa quanto sia semplice (NH4)2Co3, È così sensibile alle innumerevoli trasformazioni che la sua struttura è un mistero sottoposto alla vera composizione del solido. Questa struttura varia anche in base alle pressioni che influenzano i cristalli.
Alcuni autori hanno scoperto che gli ioni sono ordinati come coplanare allineati da ponti idrogeno (cioè una catena con una sequenza NH4+-Co32--...) in cui le molecole d'acqua probabilmente servono da connettori ad altre catene.
Ancora di più, trascendendo il cielo terrestre, come sono questi cristalli in condizioni spaziali o interstellari? Quali sono le tue composizioni in termini di stabilità delle specie gassate? Ci sono studi che confermano la grande stabilità di questi cristalli intrappolati nelle masse di ghiaccio planetario e comete.
Ciò consente loro di fungere da riserve di carbonio, azoto e idrogeno, che, che ricevono radiazioni solari, possono essere trasformate in materiale organico come gli aminoacidi.
Cioè, questi blocchi ammoniaci del gelato potrebbero essere portatori di "la ruota che inizia i macchinari della vita" nel cosmo. Per questi motivi, il loro interesse per il campo dell'astrobiologia e della biochimica sta aumentando.
Usi/applicazioni
Viene usato come Leuer, poiché essere riscaldati produce anidride carbonica e gas di ammonio. Il carbonato di ammonio è, se vuoi, un precursore della moderna polvere di cottura e può essere usato per cuocere biscotti e biscotti piatti.
Tuttavia, il suo uso per cuocere le torte non è raccomandato. A causa dello spessore delle torte, i gas di ammonio vengono trattenuti all'interno e producono un sapore spiacevole.
Può servirti: cicloesco: struttura, proprietà, sintesi e usiÈ usato come espettorante, cioè allevia la tosse quando si decongistra i bronchi. Ha un'azione fungicida, usando per questo motivo in agricoltura. È anche un regolatore dell'acidità presente negli alimenti ed è utilizzato nella sintesi di urea organica in elevate pressioni e Hidantoinas.
Rischi
Il carbonato di ammonio è altamente tossico. Produce nell'uomo un'irritazione acuta della cavità orale quando si mette in contatto.
Inoltre, se ingerito provoca irritazione gastrica. Un'azione simile si osserva agli occhi esposti al carbonato di ammonio.
L'inalazione di gas di decomposizione del sale può irritare il naso, la gola e i polmoni, causando tosse e angoscia respiratoria.
L'esposizione acuta del cane su ammonato ammonato alla dose di 40 mg/kg di peso, provoca vomito e diarrea. Le dosi più alte di carbonato di ammonio (200 mg/kg di peso) sono generalmente letali. Il danno cardiaco è indicato come la causa della morte.
Se viene riscaldato a temperature molto elevate e in un'aria arricchita con ossigeno, emana gas tossici2.
Riferimenti
- PUBCHEM. (2018). Carbonato di ammonio. Estratto il 25 marzo 2018 da PubChem: PubChem.NCBI.Nlm.NIH.Gov
- Portale di chimica organica. ((2009-2018)). Reazione Bucherer-Bergs. Estratto il 25 marzo 2018 da Organic Chemistry Portal: WWW.Chimica organica.org
- Wikipedia. (2018). Carbonato di ammonio. Estratto il 25 marzo 2018 da Wikipedia: in.Wikipedia.org
- La compagnia chimica. (2018). La compagnia chimica. Estratto il 25 marzo 2018 da The Chemical Company: Thechemco.com