Calore latente
- 1184
- 147
- Cosetta Messina
Cos'è il calore latente?
Il calore latente è la quantità di calore che deve assorbire o staccare una sostanza per cambiare condizione fisica o fase, mantenendo la temperatura costante durante quel processo. Il calore fornito o rilasciato non si manifesta, non "si sente" come al solito in una variazione di temperatura; Da qui il termine del calore latente.
La parola latente deriva dalla parola latina "latenns" che significa nascosto, quindi il calore latente si comporta come se non esistesse quando la temperatura è costante. Ma c'è: quello che succede è che è completamente consumato nel cambio di fase o in condizioni fisiche.
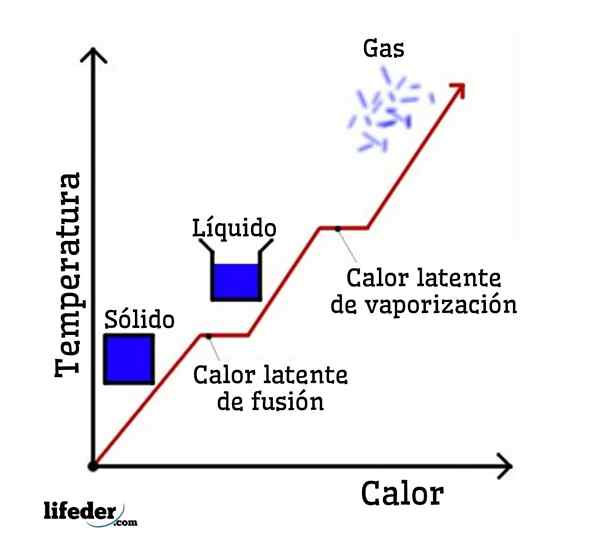
Se l'acqua viene presa come esempio, i cambiamenti di fase sono i seguenti: Ice (solido) si scioglie in acqua liquida (liquida) in un processo chiamato fusione; e l'acqua liquida a sua volta vaporizza per trasformarsi in vapore acqueo (gas) in un processo chiamato vaporizzazione.
D'altra parte, il vapore acqueo viene raffreddato in acqua liquida in un processo chiamato condensa; e l'acqua liquida diventa di nuovo ghiaccio in un processo chiamato solidificazione.
Ognuno di questi cambiamenti di fase ha un calore latente associato, che può essere positivo (assorbimento) o negativo (rilascio).
Calore di fusione latente
 Cambiare da solido a liquido; fusione
Cambiare da solido a liquido; fusione È la quantità di calore che deve essere fornita a una certa quantità di sostanza solida per cambiare le sue condizioni fisiche da solido a liquido. Durante la fusione non vi è alcun cambiamento di temperatura, quindi mentre il solido viene fondato o scioglie il liquido che viene generato da esso ha la stessa temperatura dell'intero solido.
Generalmente, questo calore è determinato nel normale punto di fusione, che è la temperatura in cui il solido inizia a fondersi sotto pressione atmosferica. A questa temperatura c'è un equilibrio o una presenza simultanei allo stesso tempo dello stato solido e dello stato liquido.
Può servirti: variabile categorica: caratteristiche ed esempiLo stato solido è caratterizzato dalla presenza di una struttura compatta dovuta all'esistenza di legami chimici a grande energia, che gli conferiscono una rigidità strutturale. Per la trasformazione di un solido in liquido, queste interazioni devono essere rotte, quindi viene consumata (assorbi) a tale scopo.
Un esempio tipico è quando viene consumato un gelato, formato da acqua, zucchero e altre sostanze. È comune osservare che il gelato, se non viene consumato rapidamente, inizia a sciogliersi, cioè sciogliersi. Ciò si verifica quando la temperatura del gelato raggiunge il punto di fusione del ghiaccio.
Esempi
Saranno elencati alcuni esempi di calore di fusione latente espressi in J/G; Cioè, l'energia che un grammo di solido deve assorbire per sciogliersi nel punto di fusione:
-Ghiaccio 334.0
-380 alluminio.0
-Zolfo 38.1
-Rame 134.0
-Etanolo 104.0
-Mercurio 11.8
-Oro 64.5
-Silver 80.3
-Piombo 24.5
-Tungsteno 184
Il ghiaccio assorbe molto il calore non perché le sue interazioni sono più forti, ma perché è in grado di dissipare eccezionalmente il calore tra i suoi cristalli.
Calore latente della vaporizzazione
È la quantità di calore che assorbe una certa quantità di sostanza per spostarsi dallo stato liquido allo stato gassoso nel normale punto di ebollizione. Cioè, è il calore che il liquido si assorbe quando bolle e diventa gas senza un aumento della temperatura.
Nel seno del fluido, le molecole di sostanza possono interagire con la formazione di ponti idrogeno e per le forze di attrazione tra le molecole. Per passare una sostanza dallo stato liquido allo stato gassoso devi superare queste forze, quindi devi fornire calore.
Il calore sensibile diventa quello che assorbe il liquido solo per aumentare la sua temperatura, che dipenderà dal suo calore specifico. Nel frattempo, il calore latente della vaporizzazione viene utilizzato per trasformarlo direttamente in vapore, un processo che è molto più semplice nel punto di ebollizione.
Può servirti: curva di calibrazione: a cosa serve, come farlo, esempiEsempi
Di seguito sono riportati esempi di alcuni liquidi con le rispettive calore latenti di vaporizzazione espresse di nuovo in J/G:
-Acido acetico 402
-Acetone 518
-Acqua 2256
-Alcool etilico 846
-Sulphur 1510
-Benzene 390
-Anidride carbonica 574
-Cloro 293
-Ether 377
-Glicerina 974
-Mercurio 295
-Ossigeno 214
Nota l'enorme calore latente di acqua liquida: 1 g di acqua liquida (circa 1 ml) deve assorbire 2256 J per vaporizzare. L'acqua liquida dissipa ancora il calore che riceve molto meglio rispetto al ghiaccio.
Calore di solidificazione latente
È il calore che deve staccare una certa quantità di sostanza per spostarsi dal suo stato liquido al suo stato solido nel punto di solidificazione o congelamento. Ancora una volta, fino a quando il liquido non si è completamente solidificato, la temperatura rimarrà costante.
Il processo di solidificazione è inverso al processo di fusione, quindi i valori del calore latente della solidificazione e quelli del calore latente della fusione sono uguali, ma di segni opposti.
Le molecole di una sostanza nello stato liquido si muovono con una certa libertà a causa dell'energia che hanno. Pertanto, per passare alla fase solida, le molecole devono rilasciare energia sotto forma di calore, che consente una maggiore interazione tra le molecole di sostanza.
L'interazione tra le molecole favorisce la formazione dei legami chimici della fase solida. Un esempio di ciò si verifica quando l'acqua liquida viene posizionata nei contenitori per la formazione di ghiaccio nel frigorifero del frigorifero. Il congelatore estrae il calore dall'acqua liquida e viene solidificato per diventare ghiaccio.
Esempi
Di seguito sono riportati alcuni esempi di calore di solidificazione latente (in J/G) per alcuni liquidi:
Può servirti: buco bianco: storia, teoria e come si forma-Acqua (-334)
-Alluminio (-380)
-Zolfo (-38)
-Rame (-134)
-Etanolo (-104)
Calore di condensa latente
È la quantità di calore che deve essere rilasciata o rilasciata da una certa quantità di sostanza, per spostarsi dallo stato del gas allo stato liquido. Il gas condensato e il liquido formato mantiene la stessa temperatura durante la condensa.
La condensa è un processo contrario alla vaporizzazione. Il calore di condensa latente ha lo stesso valore del calore latente della vaporizzazione, ma con il segno opposto e nel punto di ebollizione. Un esempio di questo è quando è cotto e il vapore è condensato nella faccia interna delle vasche.
Le molecole gassose si muovono liberamente guidate dall'energia che hanno. Pertanto, devono rilasciare l'energia per consentire l'istituzione delle interazioni intermolecolari dello stato liquido tra le molecole della sostanza.
In natura ci sono molti altri esempi del fenomeno della condensa dell'acqua. Il vapore acqueo sale nell'atmosfera e si condensa nelle nuvole sotto forma di gocce d'acqua.
C'è anche la presenza di goccioline d'acqua nel vetro di auto, prodotto della condensa dell'acqua a causa di una diminuzione della temperatura al mattino presto.
Esempi
Infine, i rispettivi calore di condensa latente espressi ancora una volta, in J/G: saranno elencati per alcuni vapori:
-Acido acetico (-402)
-Acetone (-518)
-Acqua (-2256)
-Alcool etilico (-846)
-Zolfo (-1510)
-Benzene (-390)
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Walter J. Moore. (1963). Chimica fisica. In cinetica chimica. Quarta edizione, Longmans.
- Wikipedia. (2020). Calore latente. Recuperato da: in.Wikipedia.org
- I redattori di Enyclopedia Britannica. (2020). Calore latente. Recuperato da: Britannica.com
- Cassetta degli attrezzi di ingegneria. (2003). Fluidi: calore latente di evaporazione. Estratto da: EngineeringToolbox.com
- Apprendimento del lume. (S.F.). Cambiamento di fase e calore ratunato. Recuperato da: corsi.Lumenarning.com

