Bilanciamento delle equazioni chimiche
- 2686
- 169
- Lino Lombardi
Qual è il bilanciamento delle equazioni chimiche?
Il bilanciamento delle equazioni chimiche è un'operazione matematica che viene effettuata per mantenere la legge di conservazione della materia nelle reazioni. La materia non è creata o distrutta. Pertanto, il numero di atomi prima e dopo una reazione chimica deve essere lo stesso, sia nei reagenti che nei prodotti.
Per bilanciare un'equazione chimica devi contare gli atomi prima e dopo la freccia. Se i numeri coincidono, significa che la reazione è bilanciata. Altrimenti, sarà necessario abbinare questi numeri modificando i coefficienti stechiometrici per prova ed errore, questo è il metodo più semplice e intuitivo per l'equilibrio.
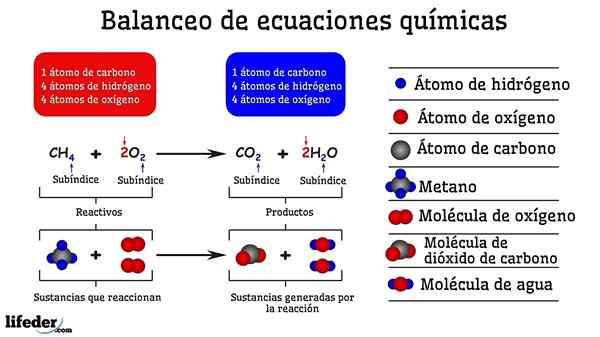
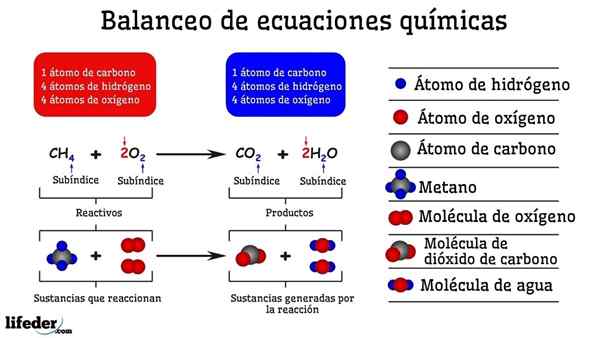 Esempio di bilanciamento chimico della reazione tra metano e due molecole di ossigeno
Esempio di bilanciamento chimico della reazione tra metano e due molecole di ossigeno Quando è bilanciato per prova ed errore, è come se fossero rimossi o aggiunti atomi in uno dei due lati della subbaja. Fino a quando il subbaja non è sospeso in orizzontale, l'equazione chimica non sarà completamente bilanciata. Non ci possono essere più (creare materia) o meno atomi (distruggere la materia) su qualsiasi lati.
Esempi di equazioni facili di bilanciamento
Nei seguenti esempi vedrai equazioni chimiche equilibrate o facili da bilanciare. Tutti devono avere in comune che il numero di atomi, per ciascuno degli elementi, sarà lo stesso prima e dopo la freccia una volta che l'equazione chimica sarà stata bilanciata.
Ossidazione del mercurio
2hg +o2 → Hg2O2
Abbiamo due elementi: Mercurio (Hg) e Oxygen (O). Esprimiamo il numero dei loro atomi prima (reagenti) e poi (prodotti) della freccia:
Hg: 2 (a sinistra) - 2 (a destra)
Può servirti: frazione molare: come viene calcolato, esempi, eserciziO: 2 (a sinistra) - 2 (a destra)
L'equazione è bilanciata perché gli atomi di Hg e o sono uguali su entrambi i lati della freccia.
Combustione dell'idrogeno
H2 + O2 → H2O
Abbiamo di nuovo due elementi: idrogeno (H) e ossigeno (O). Ripetendo il passaggio precedente:
H: 2 - 2
O: 2 - 1
Sul lato sinistro c'è un ossigeno più che a destra. Dobbiamo quindi aggiungere un altro ossigeno giusto. Per fare ciò, modifichiamo i coefficienti stechiometrici, che sono i numeri che accompagnano e precedono le formule. Se posizioniamo un 2 davanti a H2O ci darà:
H2 + O2 → 2h2O
H: 2 - 4
O: 2 - 2
L'ossigeno è equilibrato. Ma non idrogeni. Devi aggiungere due idrogeni ora a sinistra:
2h2 + O2 → 2h2O
H: 4 - 4
O: 2 - 2
E l'equazione è finalmente bilanciata: lo stesso numero di H e o prima e dopo la freccia.
Si noti che coefficienti stechiometrici (2 per H2 e 1 per la o2) Moltiplica gli abbonamenti delle formule. Questa moltiplicazione ci darà il numero totale di atomi per un elemento specifico.
Riduzione del magnesio
Mg (n3)2 + 2li → mg +2lino3
Valutiamo i numeri degli atomi per ogni elemento:
Mg: 1 - 1
Li: 2 - 2
N: 2 - 2
O: 6 - 6
L'equazione chimica è già bilanciata e non è necessario bilanciarla.
Esercizi risolti
Prima di procedere a bilanciare qualsiasi equazione, è sempre necessario confermare se non è più bilanciato. Detto questo, procediamo con il seguente esercizio:
Esercizio 1
Equilibrato o no?
Fede2O3 + H2O → Faith (Oh)3
Abbiamo tre elementi: ferro (fede), idrogeno e ossigeno. Un suggerimento al momento delle equazioni dell'equilibrio è iniziare a contare il numero di atomi dell'elemento meno abbondante nell'equazione; che di solito è diverso da H e O. Quindi, contiamo prima gli atomi della fede:
Può servirti: metil salicilatoFede: 2 - 1
Sobbroposto 3 di (OH)3 Non moltiplicare la fede a sinistra. Per H e O abbiamo:
H: 2 - 3
O: 4 - 3
Tutti gli elementi sono sbilanciati.
Oscillante
Prima ancora di bilanciare H e O, dobbiamo bilanciare gli atomi della fede: l'elemento meno abbondante, poiché non c'è quasi 3 fede, a differenza di 5 ore e 7 o 7 o 7. Devi aggiungere, quindi, una fede a destra:
Fede: 2 - 2
Ciò che è uguale a mettere un 2 come coefficiente stechiometrico di fronte alla fede (OH)3. L'equazione rimarrà:
Fede2O3 + H2O → 2fe (OH)3
Fede: 2 - 2
H: 2 - 6
O: 4 - 6
Ma H e O o continuano sbilanciati. Un h2O contribuisci a 2 ore e ci manca 4 ore. Pertanto, aggiungeremo altre due h2O per noi di avere tre H2O:
Fede2O3 + 3h2O → 2fe (OH)3
E valutiamo di nuovo:
Fede: 2 - 2
H: 6 - 6
O: 6 - 6
Nota come li stavano bilanciando una volta che una volta abbiamo bilanciato l'H. L'equazione è finalmente bilanciata.
Esercizio 2
Equilibrato o no?
Cap4 + O2 → CO2 + H2O
Valutiamo il numero di atomi per tutti gli elementi attuali:
C: 1 - 1
H: 4 - 2
O: 2 - 3
Il carbonio è bilanciato, ma lo stesso non accade con idrogeno e ossigeno. L'equazione è sbilanciata.
Oscillante
Poiché la C è bilanciata, non vogliamo modificare i coefficienti stechiometrici di CH4 o co2. Almeno non in linea di principio.
Focalizziamo la nostra attenzione su H e O, specialmente su H. Perché? Perché vedere l'equazione è più facile bilanciare H prima o. Dobbiamo aggiungere 2 ore a destra, posizionando un coefficiente 2 davanti a H2O:
Cap4 + O2 → CO2 + 2h2O
C: 1 - 1
H: 4 - 4
O: 2 - 4
C e H sono bilanciati. Siamo lasciati 2 o lasciati. Se ciascuno o2 contribuisce 2 o, aggiungeremo un o2 extra in modo che siano 4 o a sinistra. Questo è lo stesso del posizionamento di un coefficiente 2 davanti a O2:
Può servirti: ossido di zolfoCap4 + 22 → CO2 + 2h2O
C: 1 - 1
H: 4 - 4
O: 4 - 4
E l'equazione è finalmente bilanciata.
Esercizio 3
Equilibrato o no?
N2 + H2 → NH3
Valutiamo per i nostri due elementi N e H:
N: 2 - 1
H: 2 - 3
L'equazione non è bilanciata.
Oscillante
Iniziamo bilanciati N, l'elemento diverso da H. Ci manca il diritto e come ogni NH3 contribuisce 1 n, dobbiamo aggiungere un altro NH3 Per avere 2 N:
N2 + H2 → 2nh3
N: 2 - 2
H: 2 - 6
E ora ci manca la sinistra. Se ogni h2 Contribuire 2 ore all'equazione, quindi dobbiamo aggiungere altri due in modo che ci siano 6 ore. Questo è lo stesso del posizionamento di un coefficiente stechiometrico 3 di fronte a H2:
N2 + 3h2 → 2nh3
N: 2 - 2
H: 6 - 6
E l'equazione chimica è finalmente bilanciata.
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Chimica librettexts. (23 novembre 2020). Come scrivere equazioni chimiche equilibrate. Recuperato da: Chem.Librettexts.org
- Wikipedia. (2020). Equazione chimica. Recuperato da: in.Wikipedia.org
- Principi di chimica. (S.F.). Scrivere e bilanciare equazioni chimiche. [PDF]. Estratto da: web.Ung.Edu
- Phet. (S.F.). Bilanciamento delle equazioni chimiche. Recuperato da: Phet.Colorado.Edu
- Armando Marín b. (S.F.). Chimica generale: bilanciamento delle equazioni. [PDF]. Recuperato da: Depa.Fquim.UNAM.MX

