Acido debole
- 2082
- 645
- Enzo De Angelis
 Esempi di acidi deboli
Esempi di acidi deboli Cos'è un acido debole?
Un acido debole è quello che nella soluzione acquosa ha scarsa capacità di dissociarsi in idrogeno (H+) e nella sua corrispondente base coniugata. A differenza degli acidi forti, la cui dissociazione è completa (100%) e praticamente irreversibili, gli acidi deboli sono appena dissociati e reversibili.
Pertanto, un acido debole genera meno heles h+ Nell'acqua di ciò che ci si aspetterebbe. Tra gli acidi deboli più rappresentativi che abbiamo acido acetico, il componente principale dell'aceto, che è approssimativamente in uno 0.5 % in condizioni normali.
Ciò significa che la più grande percentuale di una soluzione di acido acetico in acqua, come l'aceto di cottura al 5%, è in forma non dissociata (CH3Cooh); Mentre una piccola porzione si trova come base coniugata (scegli3COO-), accompagnato da ioni H+, o più correttamente, ioni H3O+.
Quindi, poiché la quantità di idrogeno che viene rilasciato da un acido debole in soluzione acquosa è bassa, il pH che produce è più elevato (di base) di quello prodotto da un forte acido. Ad esempio, l'aceto ha un pH di 2.5, succo d'arancia pH 3.3. 4.2 e il succo di 2 limone di 2.
Questi pH, sebbene siano acidi, sono più alti del pH che producono una soluzione di un acido forte (HCl, H2SW4, eccetera.) che possano raggiungere il valore di 1 o meno (valori di pH negativo).
Caratteristiche degli acidi deboli
PH delle tue soluzioni
Gli acidi deboli di solito hanno un pH tra 2.0 e meno di 7.0, così girano il colore della carta Pannasol in rosso. Questi valori di pH sono molti più alti dei valori di pH prodotti da acidi forti, sebbene ci siano eccezioni.
Ad esempio, una soluzione di acido cloridrico da 1 mm (un acido forte), ha un pH di 3.0, mentre una soluzione da 1 mm di acido fluorotto (un acido "debole"), ha un pH di 3.2, che è vicino a quello di forte acido.
Ionizzazione parziale
Gli acidi deboli in soluzione sono ionizzati poco o parzialmente in acqua, dissociando nella base coniugata di acido e idrogeno. Quindi, un acido debole in soluzione acquosa è per lo più dissociata, con una piccola proporzione dissociata.
Può servirti: bilanciamento delle equazioni chimicheQuando la quantità di idrogeno rilasciato da un acido debole in acqua è bassa, il pH prodotto da questo acido è superiore a quello prodotto da un forte acido sciolto in acqua, poiché questi sono generalmente ionizzati del 100 %.
Ionizzazione reversibile
La ionizzazione di un acido debole è generalmente schematizzata come segue:
Ha ⇌ a- + H3O-
Dove c'è acido debole, a- la sua base coniugata e h3O+ il catione di idronio, che è la strada in H+ Esiste o si manifesta in acqua. La concentrazione (o l'attività) di H3O+ È usato al posto di h+ Per la determinazione della soluzione della soluzione.
Grado di ionizzazione
Alcuni acidi sono più deboli di altri, il che è lo stesso da dire, sono meno ionizzati. Pertanto, il grado di ionizzazione ci consente di intravedere quanto sia acido un acido in determinate condizioni.
Per esprimere il grado di ionizzazione, sono stati introdotti diversi parametri, come la costante di ionizzazione o acidità (KA) e la PKA: un modo per esprimere KA in un numero semplice che omette l'uso di un numero espresso in poteri negativi di dieci (10 (10 ), come esiste nel ka.
Le costanti KA e PKA sono utilizzate principalmente per gli acidi deboli.
Ka = [a-] [H+] / [Ha]
Le staffe presenti nella formula rappresentano le concentrazioni.
pka = - log ka
Il valore PKA di un acido debole di solito varia tra 2 e 12. Ma ci sono eccezioni. Ad esempio: e e acido odagico (Hio3) ha un PKA di 0.77, che è considerato un valore relativamente piccolo, ma senza essere negativo, per un acido debole in senso stretto.
Stabilità della base coniugata
Gli acidi deboli hanno un forte legame con l'atomo di idrogeno acido (HΔ+-XΔ-), quindi hanno un basso grado di dissociazione dell'idrogeno. Ciò si traduce nella base coniugata dell'acido debole ha una grande avidità per idrogeno, essendo una base coniugata forte.
Può servirti: colloideCioè, la base coniugata di un acido debole è molto instabile, perché accetta h+ restituito molto facilmente. Più è instabile questa base coniugata, più debole sarà in discussione.
Bassa conduttività ionica
Essendo piccoli ionizzati, gli acidi deboli sono poveri conduttori di elettricità, a differenza degli acidi forti che sono buoni conduttori di elettricità.
Presenza in natura
Gli acidi deboli sono ampiamente distribuiti in natura, ad esempio, sono in frutta di agrumi (limone, pompelmo, arancione, ecc.).
Sono anche presenti in numerosi processi che si verificano in tutti gli esseri viventi. Alcuni di questi acidi deboli biologici sono piruvici, lattici, citrici, fumarici, succinici, glutamici, ecc., E persino l'emoglobina ossigenata rilascia idrogenioni, quindi si comporta come un acido debole.
Quindi, si può concludere che l'uomo vive in contatto permanente con acidi deboli.
Come calcolare il pH di un acido debole?
Il pH di un acido debole può essere calcolato usando la costante di acidicizzazione (KA) o usando l'equazione di Henderson-Haselbalch. Nel primo esempio verrà utilizzato ka.
Con costante di acidità
Calcola il pH di una soluzione 0.5 m di acido benzoico (C6H5COOH), che ha una costante di ionizzazione (ka) = 1.8 x 10-5
C6H5COOH ⇌ c6H5COO- + H+ (1)
Se la quantità di acido che si dissocia è chiamata x, allora 0.5 m-x sarà la concentrazione di acido debole non dissociata in equilibrio, essendo x la concentrazione della base coniugata di acido benzoico e concentrazione di ioni idrogeno.
L'equazione (1) può essere rappresentata come segue:
0.5 m-x ⇌ x +x
Gli acidi deboli sono ionizzati in una proporzione molto bassa, quindi la concentrazione di acido benzoico nell'equilibrio di (0.5 m-x), può essere assunto come 0.5 m, da X <<< 0.5. Sustituyendo en la expresión de Ka resolvemos para X:
Ka = [a-] [H+] / [Ha]
1.8 x 10-5 = (X) (x) / 0.5m
X2 = (1.8 x 10-5) (0.5m)
X = 3 x 10-3 M
Pertanto, [H+] è uguale a 3 x 10-3 M. Quindi risolviamo calcolando il pH:
Può servirti: metodo MOHR: fondamentali, reazioni, procedura, usiph = - log [h+"
= - log [3 x 10-3"
pH = 2.52
Si noti che il pH è relativamente acido, in quanto si trova al di sotto di 3 o 4.
Con l'equazione di Henderson-Haselbalch
L'equazione di Henderson-Haselbalch viene utilizzata per calcolare il pH di una soluzione tampone:
ph = pka + log [base coniugata] / [acido]
Esempio:
L'idrossido di sodio (NaOH) viene aggiunto a una soluzione di acido acetico, producendo una concentrazione finale di acido acetico (CH3COOH) 1.11 x 10-2 mol/L e una concentrazione di base coniugata (scegli3COO-) di 0.44 x 10-2 mol/l. Se l'acido acetico PKA è 4.75 Calcola il pH della soluzione.
pH = 4.75 +log [a-] / [Ha]
pH = 4.75 +registro (0.44 x 10-2 / 1.11 x 10-2)
= 4.75+ log 0.396
= 4.348
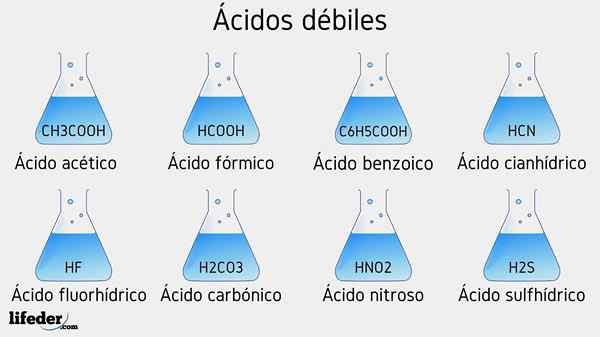
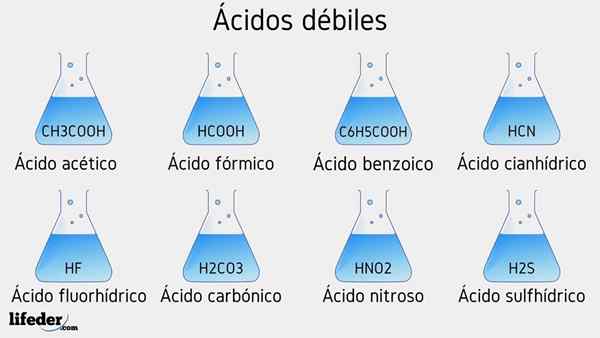
Esempi di acidi deboli
Di seguito saranno elencati diversi acidi deboli accompagnati dai loro valori PKA:
- Cap3COOH (acido acetico), PKA 4.75
- HCOOH (acido formico), PKA 3.74
- C6H5COOH (acido benzoico), PKA 5.59
- Cap2Clcooh (acido cloroacetico), PKA 2.85
- HCN (acido cianidrico), PKA 9.31
- HF.17
- C2H5COOH (acido propionico), PKA 4.89
- Hno2 (Acido nitroso), PKA 3.35
- H2S (acido solfuro), pka1 6.0 e pka2 12.92
- CCL3COOH (acido tricloroacetico), PKA 0.52
- H2Co3 (acido carbonico), PKA1 6.37 e PKA2 10.22
- H3Po4 (acido fosforico), PKA1 2.12, PKA2 4.21 e PKA3 undici.0
- C6H5SW3H (acido benzefonico), PKA 0.70
- Hio3 (Acido yodium), PKA 0.77
- HCLO2 (Acido cloro), PKA 2.0
- Cap3Cap2(OH) COOH (acido lattico), PKA 3.08
Acidi deboli con usi terapeutici
- Acido salicilico, PKA 3.00
- Acido acetilsalicilico, PKA 3.49
- Furosemide, PKA 3.90
- Ibuprofene, pka 4.40
- Levodopa, PKA 2.30
- Phenobarbital, PKA 7.40
- Warfarina, PKA 5.0
- Teofilina, PKA 8.80
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Morris, j. G. (1974). FisicoCochimica per i biologi. (2nd ed.). Ho invertito.
- Helmestine, Anne Marie, PH.D. (29 agosto 2020). Definizione acida debole ed esempio in chimica. Recuperato da: Thoughtco.com
- Ophardt c., & McCarthy l. (15 agosto 2020). Acido e forza di base. Chimica librettexts. Recuperato da: Chem.Librettexts.org
- Clark Jim. (2013). Acido forte e debole. Recuperato da: ChemGuide.co.UK
- Apprendimento del lume. (S.F.). Chimica per i non-major: calcolo del pH di soluzioni di acido e base deboli. Recuperato da: corsi.Lumenarning.com

