Boroidride di sodio (NABH4) struttura, proprietà, usi

- 4929
- 63
- Lidia Valentini
Lui boro di sodio È un solido inorganico la cui formula chimica è Nabh4. Può essere considerato rappresentativo del boroidruro alcalino ed è il più comune di questi. È un solido bianco cristallino.
Al contatto con l'acqua, il Nabh4 può generare calore e idrogeno H2 che è carburante, quindi deve essere gestito con cautela. Per la facilità con cui può generare ioni idruri h-, Il boro di sodio è un composto che riduce moderatamente, quindi è ampiamente utilizzato nelle reazioni chimiche a questo scopo.
 Boroidride di sodio, Nabh4, solido. Ondřej mangl [dominio pubblico]. Fonte: Wikimedia Commons.
Boroidride di sodio, Nabh4, solido. Ondřej mangl [dominio pubblico]. Fonte: Wikimedia Commons. La sua proprietà riducente viene utilizzata anche nel settore della carta, poiché consente di migliorare le caratteristiche della luminosità e della stabilità della polpa e della carta quando agiscono contro l'ossidazione della cellulosa, componente principale della carta.
Poiché in presenza di acqua può facilmente formare idrogeno, è stata anche studiata la possibilità di usarlo come fonte di idrogeno reversibile nelle celle a combustibile.
Ha altri usi tutti in base alla sua proprietà riducente, come nell'industria farmaceutica.
[TOC]
Struttura
Il boro di sodio è un composto ionico. È formato da anione boroidride [BH4"- Insieme alla na catione di sodio+.
L'anione [BH4"- È tetraedrico.
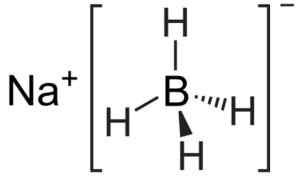 Struttura di boroidride di sodio. Kemikungen [dominio pubblico]. Fonte: Wikimedia Commons.
Struttura di boroidride di sodio. Kemikungen [dominio pubblico]. Fonte: Wikimedia Commons. La sua struttura Lewis è la seguente:
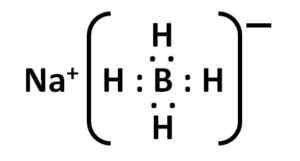 Struttura elettronica di Nabh Lewis4. Autore: Marilú Stea.
Struttura elettronica di Nabh Lewis4. Autore: Marilú Stea. Nomenclatura
-Boro di sodio
-Tetraidroato di sodio
-Sodio tetraidrurorat
Proprietà fisiche
Stato fisico
Solido bianco cristallino.
Peso molecolare
37,84 g/mol
Temperatura di autorezione
∼ 220 ºC
temperatura di decomposizione
> 250 ºC
Densità
1.074 g/cm3 a 20 ºC
Può servirti: reagente Grignard: preparazione, applicazioni, esempiSolubilità
Il nabh4 È abbastanza solubile in acqua (55 g/100 ml a 25 ° C), dove parzialmente idrolizzati. È solubile in tetraidrofurano (THF) ed è insolubile nella dieta etere.
Proprietà chimiche
Il boro di sodio viene sciolto in acqua, dove subisce una decomposizione iniziale o idrolisi che rende la soluzione di base, che impedisce l'idrolisi successiva.
[BH4"- + H2O → B (OH)3 + H2↑ + Oh-
Questo è spiegato perché [BH4"- Interagisci con h+ Di acqua, dove h+ Prendi un anione Hidruro H- Formare h2. Si può dire che il BH3 compete con h+ Per l'idruro h-.
Nel mezzo acido l'idrolisi è completa a causa dell'abbondanza di ioni H+.
Il nabh4 È stabile in aria secca. Non è volatile.
A causa del suo contenuto di ioni idruro, il boro di sodio è un composto riducente. Permette di ridurre il gruppo carbonilico C = o a c-oh, cioè composti carbonilici agli alcoli.
Il nabh4 Da solo non riduce i doppi legami c = c, nemmeno i coniugati con i gruppi carbonilici -C = c -c (= o)-.
Tuttavia, quando si entra in contatto con acidi protonici (come HCL) o acidi Lewis (come BCL3 o Alcl3) Si forma diborano b2H6. E se questa reazione viene eseguita in presenza di composti organici con doppi legami c = c il diborano B2H6 Esegue l'idrobazio di questi.
In presenza di catalizzatori appropriati e condizioni specifiche il boro di sodio può ridurre vari tipi di gruppi funzionali.
Rischi
Il calore della reazione di idrolisi in acqua è sufficiente per accendere l'idrogeno che si forma in esso. Quindi è importante fare attenzione quando lo manipola.
Il nabh4 È facilmente acceso ed è facilmente bruciato.
Ottenimento
La tipica reazione di preparazione NABH4 È attraverso l'idruro di sodio nah e b (Och3)3 A una temperatura di circa 250 ºC:
Può servirti: elettrolisi dell'acqua4 nah + b (Och3)3 → Nabh4 + 3 Naoch3
Applicazioni
Nelle reazioni chimiche di riduzione
Per essere una fonte di henes h-, Il nabh4 È un composto riducente e viene utilizzato per preparare altri composti chimici. Per fare questo, è usato nei solventi polari apratotici, cioè senza protoni H+, come dimetilsolfossido, esametilfosfora e dimetiloformamide.
È usato come agente riducente nelle reazioni di chimica sia organica che inorganica.
Permette di ridurre aldeidi agli alcoli primari e ai chetoni agli alcoli secondari.
Riduce anche gli alogenuri alchilici a idrocarburi come lo iododan a Dean.
Se agisce da solo, quando si effettua la riduzione non influisce su altri gruppi funzionali come estere, acido carbossilico, nitrile e solfone.
La sua proprietà di non ridurre i doppi legami C = C, nemmeno i coniugati con i gruppi carbonilici -C = C-C (= O)-, consente di preparare alcoli insaturi -C = C-CH2-OH.
Per ridurre i nitrado dei composti aromatici alle loro corrispondenti aniline richiede la presenza di catalizzatori come il cloruro di cobalto o la stagno. Ridurre i disolfuri ai tiolle.
In presenza di condizioni e catalizzatori appropriati, consente di ridurre acidi carbossilici, esteri, mezzo, nitrili, imina, epossidi e persino doppi e tripli legami.
In h2 Nelle celle a combustibile
Il nabh4 Può essere trasformato in una cella a combustibile.
Il nabh4 In presenza di una soluzione alcalina di KOH o NaOH è idrolizzata e produce idrogeno H2 che può essere utilizzato come carburante in una batteria di carburante elettrolitico polimerico.
È stato anche studiato come materiale H per la conservazione H di H2 reversibilmente.
Le nanoparticelle di Nabh sono sintetizzate4 e stabilizzare con un tensioattivo. Dopo un trattamento con NICL2 Si forma uno strato o un rivestimento protettivo che regola il rilascio di H2 completamente reversibile.
Può servirti: nitrato d'argento (agno3): struttura, proprietà, usi, tossicitàQuesto nuovo materiale nanometrico consentirebbe l'uso di H2 Come combustibile pulito e rinnovabile prodotto.
 Veicolo che funziona con le celle a combustibile idrogeno. Dottore. Artur Braun (Arturbraun) [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons.
Veicolo che funziona con le celle a combustibile idrogeno. Dottore. Artur Braun (Arturbraun) [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]. Fonte: Wikimedia Commons. Nell'industria della polpa e della carta
Il boro di sodio viene utilizzato per migliorare la luminosità e altre proprietà fisiche di polpa e carta.
La degradazione della matrice cellulosica dell'articolo si verifica attraverso processi complessi che comportano l'ossidazione. I gruppi idrossilici ossidano il carbonile e il carbossil, questo porta allo scolorimento della carta e alla riduzione delle proprietà fisiche.
Quando si tratta la polpa o la carta con Nabh4, Ciò riduce aldeidi e chetoni ai gruppi -OH senza influire sui gruppi carbossilici acidi, migliorando la stabilità e la luminosità a valori superiori alle iniziali.
 Il nabh4 consente di migliorare la luminosità della carta. Autore: Rawpixel. Fonte: Pixabay.
Il nabh4 consente di migliorare la luminosità della carta. Autore: Rawpixel. Fonte: Pixabay. In diversi usi
Il boro di sodio viene utilizzato per trattare le acque reflue, come agente improprio del sapore nell'industria alimentare e delle bevande, come agente di rivestimento e per il trattamento delle superfici, nella produzione di tabacco, nel settore farmaceutico, tessile e tessile in pelle.
Riferimenti
- Cristiano, m.L. e Aguey-Zinsou, K.-F. (2012). Strategia di core-guscio che porta ad un'elevata capacità di accumulo di idrogeno reversibile per NABH4. ACS Nano 2012, 6, 9, 7739-7751. Recuperato dai pub.sindrome coronarica acuta.org.
- Nora de souza, m.V. e Alves v., T.R. (2006). Metodologie recenti mediate dalla boroidruro di sodio nella riduzione di diverse classi di composti. App. Organometale. Chimica. 2006; 20: 798-810. Estratto dalla biblioteca online.Wiley.com.
- Imamoto, t. (1991). Riduzione. Boroidride di sodio. Nella comprensione della sintesi organica. Recuperato da ScienceDirect.com.
- Tang, l.C. (1986) Stabilizzazione della carta attraverso il trattamento di boroidride di sodio. In tessili storici e materiali di carta. Capitolo 24. Pagine 427-441. Progressi in chimica, volume 212. Recuperato dai pub.sindrome coronarica acuta.org.
- Cotone, f. Albert e Wilkinson, Geoffrey. (1980). Chimica inorganica avanzata. Quarta edizione. John Wiley & Sons.
- Morrison, Robert Thornton; e Boyd, Robert Neilson. 1992. Chimica organica. Prentice-Hall. ISBN 81-203-0765-8.
- O.S. Biblioteca nazionale di medicina. (2019). Boroidride di sodio. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov.
- « Caratteristiche ed esempi del fenomeno sociale
- Cloruro di cobalto (COCL2 (struttura, nomenclatura, proprietà »

