Caratteristiche della beta galattosidasi, struttura, funzioni
- 1357
- 53
- Dante Morelli
IL Beta galattosidasi, Chiamato anche β-galattosidasi o β-D-galattoidrotise è un enzima appartenente alla famiglia di idrolasi glicosil in grado di idrolizzarsi lo spreco di galattosil di diversi tipi di molecole: polimeri, oligosaccaridi e metaboliti secondari.
Precedentemente noto come "lattasi", la sua distribuzione, nonché quella dei polisaccaridi oligo- e β-galattosità che fungono da substrato, è estremamente ampia. Si trova in batteri, funghi e lieviti; Nelle piante è comune in mandorle, pesche, albicocche e mele e negli animali è presente in organi come lo stomaco e l'intestino.
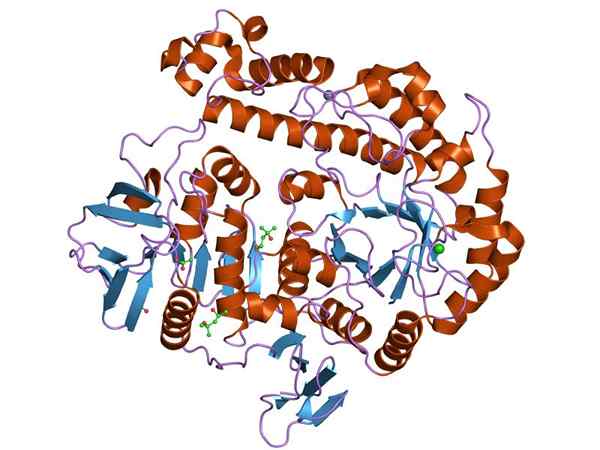
 Rappresentazione grafica della struttura dell'enzima B-galattosidasi (Fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Dominio pubblico] tramite Wikimedia Commons)
Rappresentazione grafica della struttura dell'enzima B-galattosidasi (Fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [Dominio pubblico] tramite Wikimedia Commons) L'enzima più studiato è quello dell'Opeon Lac Di E. coli, Gen codificato Lacz, i cui studi sono stati fondamentali per comprendere il funzionamento degli operat genetici e molti aspetti regolatori di essi.
Attualmente appartiene al gruppo enzimatico migliore e la loro funzione più nota è quella dell'idrolisi dei legami glucosidici del lattosio. Soddisfa le funzioni metaboliche essenziali negli organismi che lo esprimono e viene utilizzato anche con diversi scopi industriali.
Tra le applicazioni industriali vi sono la rimozione del lattosio di prodotti lattiero -caseari per le persone intolleranti al lattosio e la produzione di diversi composti di galattosità. Sono anche usati per migliorare la dolcezza, il gusto e la digestione di molti prodotti lattiero -caseari.
[TOC]
Caratteristiche
Oltre ai substrati di galattosità come il lattosio, la maggior parte delle β-galattosidasi note richiedono ioni metallici bivalenti come magnesio e sodio. Ciò è stato dimostrato con la scoperta di siti sindacali per questi metalli nella sua struttura.
Le β-galattosidas presenti in natura hanno una grande varietà di gamme di pH a cui possono lavorare. Gli enzimi fungini funzionano in ambienti acidi (2.5 a 5.4), mentre lieviti e batteri funzionano tra 6 e 7 unità di pH.
Può servirti: batteri gram negativiβ-galattosidas batterico
I batteri hanno grandi enzimi galato-idrolitici rispetto ad altri galattosidas analizzati. In questi organismi, lo stesso enzima catalizza tre tipi di reazioni enzimatiche:
- Lattosio idroliza ai suoi monosaccaridi costitutivi: galattosio e glucosio.
- Catalizza la transgastilazione del lattosio nell'alolattosio, uno zucchero disaccaridico che partecipa alla regolazione positiva dell'espressione dei geni appartenenti all'opeone Lac, Eç.
- Idrolizza l'alolattosio simile a come fa con il lattosio.
β-galattosidas fungino
I funghi hanno enzimi β-galattosidasi più suscettibili all'inibizione del galattosio rispetto agli enzimi appartenenti ad altri organismi. Tuttavia, questi sono termostabili e funzionano nelle fasce di pH acido.
Il metabolismo del lattosio mediato da questi enzimi nei funghi è diviso in extracellulare e citosolico.
Struttura
L'enzima β-galattosidasi dei batteri è un enzima tetramericano (di quattro subunità identiche, A-D) e ciascuno dei suoi monomeri ha più di 1.000 rifiuti di aminoacidi, il che significa un peso molecolare di oltre 100 kDa per ciascuno e più di 400 kDa per la proteina complessa.
Nelle piante, al contrario, l'enzima ha dimensioni considerevolmente più piccole e può essere comunemente trovato come un dimero di subunità identiche.
I domini di ciascun monomero si distinguono con i numeri da 1 a 5. Il dominio 3 ha una struttura a canna α/β "TIM" e ha il sito attivo all'estremità C-terminale della canna.
Può servirti: organogenesi animale e vegetale e le sue caratteristicheSi presume che i siti attivi del complesso enzimatico siano condivisi tra i monomeri, quindi questo enzima è biologicamente attivo solo quando è complesso come tetrametro.
Il suo sito attivo ha la possibilità di unire d-glucosa e d-galattosio, i due monosaccaridi che compongono il lattosio. È particolarmente specifico per il d-galattosio, ma non è tanto per il glucosio, quindi l'enzima può agire su altri galattosidi.
Funzioni
Negli animali
Nell'intestino degli esseri umani, la funzione principale di questo enzima ha a che fare con l'assorbimento del lattosio ingerito con il cibo, poiché si trova sulla faccia luminale della membrana plasmatica delle cellule intestinali sotto forma di una spazzola.
Inoltre, è stato dimostrato che le isoforme lisosomiali di questo enzima partecipano alla degradazione di molti glucolipidi, mucopolisaccaridi e glicoproteine di galattosità, che ha più scopi cellulari.
Nelle piante
Le piante hanno enzimi β-galattosidasi su foglie e semi. Questi svolgono importanti funzioni nel catabolismo dei galattolipidi, che sono caratteristiche di alghe e piante in generale.
In questi organismi, la β-galattosidasi partecipa ai processi di crescita delle piante, maturazione dei frutti e, nelle piante superiori, questo è l'unico enzima noto in grado di idrolizzare i rifiuti di galattosile dai polisaccaridi di galacosità della parete cellulare.
Nell'industria e nella ricerca
Nell'industria alimentare legata ai prodotti lattiero-caseari, l'enzima β-galattosidasi viene utilizzato per catalizzare l'idrolisi del lattosio presente nei prodotti lattiero-caseari, che è responsabile di molti dei difetti relativi allo stoccaggio di questi prodotti.
L'idrolisi di questo zucchero cerca di evitare la sedimentazione delle particelle, la cristallizzazione dei dessert lattiero -caseari congelati e la presenza di trame "sabbiose" nella maggior parte dei derivati commerciali del latte.
Può servirti: catena alimentare terrestre: collegamenti ed esempioLa β-galattosidasi utilizzata industrialmente si ottiene, comunemente, dal fungo Aspergillus sp., Sebbene l'enzima prodotto dal lievito Kluyveromyces lactis È anche ampiamente usato.
L'attività della β-galattosidasi, che si traduce in termini scientifici come la "fermentazione del lattosio", viene abitualmente testata per l'identificazione degli enterobatteri negativi Gram presenti in diversi tipi di campioni.
Inoltre, in termini medici, viene utilizzato per la produzione di latticini senza lattosio e per la formulazione di compresse utilizzate dalle persone intolleranti al lattosio per digerire il latte e i loro derivati (yogurt, formaggio, gelato, burro, creme, ecc.).
È usato come "biosensori" o "biomarcatori" con diversità di scopi, dai test immunologici e analisi tossicologiche all'analisi dell'espressione genica e alla diagnosi di patologie grazie all'immobilizzazione chimica di questo enzima in supporto speciale.
Riferimenti
- Henrissat, n., & Daviest, G. (1997). Classificazione strutturale e basata su sequenza di idrola di glicoside. Biologia attuale, 7, 637-644.
- Huber, r. (2001). Beta (b) -galattosidasi. Academic Press, 212-214.
- Husain, q. (2010). β galattosidase e le loro potenziali applicazioni: una revisione. Recensioni critiche in biotecnologia, 30, 41-62.
- Giudice, d. H., Matthews, b. W., & Huber, R. E. (2012). Lacz B-galattosidasi: struttura e funzione di un enzima di importanza biologica storica e molecolare. Proteina scientifica, ventuno, 1792-1807.
- Lee, b. E., Han, J. A., Im, J. S., Morrone, a., Johung, k., Goodwin, c.,... Hwang, e. S. (2006). La β -galattosidasi associata dalla senescenza è lisosomiale β -gastosidasi. Cella che invecchia, 5, 187-195.
- Matthews, b. W. (2005). La struttura di E. β-galattosidasi coli. C. R. Biologie, 328, 549-556.
- McCarter, J. D., & Withers, s. G. (1994). Meccanismi di idrolisi glicosidica enzimatica. Opinione attuale in biologia strutturale, 4, 885-892.
- Richmond, m., Gray, J., & Stine, C. (1981). Beta-galattosidasi: revisione del recente relativo all'applicazione tecnologica, alle preoccupazioni nutrizionali e all'immobilizzazione. J Dairy Sci, 64, 1759-1771.
- Wallenfels, k., & Weil, r. (1972). B-galattosidasi.
- « Caratteristiche del metodo di costo minimo, vantaggi, svantaggi
- Metodo ungherese cosa consiste, esempio »

