Caratteristiche di asparagina, struttura, funzioni, biosintesi
- 3687
- 921
- Benedetta Rinaldi
IL Asparagina (ASN o N) è un aminoacido importante per la segnalazione cellulare e l'unione tra proteine e carboidrati. Questo è uno dei 22 aminoacidi di base ed è catalogato come non essenziale, in quanto è sintetizzato dal corpo dei mammiferi.
Questo aminoacido è classificato all'interno del gruppo di aminoacidi polari senza carico ed è stato il primo aminoacido nudo, un fatto che si è verificato nel 1806, dove è stato isolato dal succo di asparagi (una specie di pianta erbacea) dalle sostanze chimiche francesi Vauquelin e Robiquet.
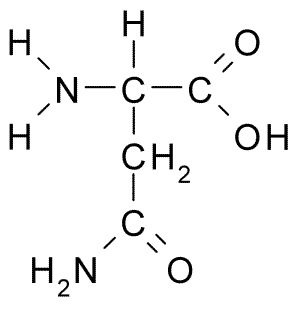
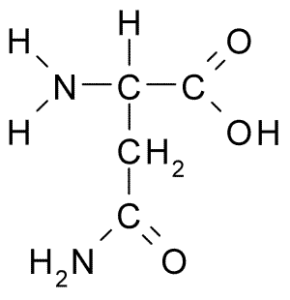 Struttura chimica dell'asparagina di aminoacidi (Fonte: Borb, via Wikimedia Commons)
Struttura chimica dell'asparagina di aminoacidi (Fonte: Borb, via Wikimedia Commons) Nonostante la sua prima scoperta, il ruolo biologico e nutrizionale dell'asparagina non fu riconosciuto ma più di 100 anni dopo quando, nel 1932, fu confermata la sua presenza nella struttura di una proteina presente nei semi di canapa.
L'asparagina e la glutammina fungono da substrati per i gruppi di due aminoacidi molto frequenti nelle proteine: rispettivamente aspartico (acido aspartico) e glutammato (acido glutammico). L'asparagina e la glutammina sono facilmente idrolizzate in questi aminoacidi mediante azione enzimatica o acido e composti di base.
Molti enzimi di serina proteasi che sono responsabili dell'idrolizzante legami peptidici hanno asparagina nella catena laterale del loro sito attivo. Questo residuo ha un carico parziale negativo ed è responsabile dell'adesione in modo complementare con il carico positivo dei peptidi bianchi, avvicinandosi al sito di taglio.
L'enzima responsabile della sintesi di ossalacetato dall'asparagina è usato nei trattamenti chemioterapici ed è noto come L-asparaginasi, che è responsabile della catalizzazione della frammentazione idrolitica dell'amida da asparagina ad aspartato e ammonio.
L'asparaginasi è troppo espressa e purificata da Escherichia coli, Essere iniettato nei pazienti per bambini che hanno la leucemia linfoblastica acuta, poiché i linfociti normali e maligni dipendono dalla cattura dell'asparagina nel sangue per la crescita e la moltiplicazione.
[TOC]
Caratteristiche e struttura
Tutte le strutture chimiche degli aminoacidi hanno un gruppo carbossilico (-COH), un gruppo amminico (-nh3+), un idrogeno (-H) e un gruppo R o sostituente che sono uniti dallo stesso atomo di carbonio centrale, noto come carbonio α.
Gli aminoacidi differiscono l'uno dall'altro per l'identità delle loro catene laterali, che sono quelle note come gruppi R e che possono variare in dimensioni, struttura, gruppi funzionali e persino carica elettrica.
Gli atomi di carbonio dei gruppi R si identificano con lettere dell'alfabeto greco. Pertanto, nel caso dell'asparagina, i carboni della catena R sono identificati come carboni β e γ.
Può servirti: agar xld: fondazione, preparazione e usiSecondo un altro tipo di nomenclature, l'atomo di carbonio nel gruppo carbossilico (-COH) è elencato come C-1, quindi, continuando con la numerazione, il carbonio α sarebbe C-2 e così via.
Una molecola di asparagina ha quattro atomi di carbonio, tra cui carbonio α, gruppo carbossilico e due atomi di carbonio che fanno parte del gruppo R, noto come carbossamide (-ch2-co-co-NH2).
Questo gruppo carbossammide si trova solo in due aminoacidi: in asparagina e glutammina. Ha la caratteristica che può formare ponti idrogeno con grande facilità attraverso il gruppo amminico (-nh2) e il gruppo carbonile (-co).
Classificazione
L'asparagina appartiene al gruppo di aminoacidi polari senza carico, che sono aminoacidi molto solubili in acqua e molto idrofili (a causa della loro capacità di formazione di ponti a più idrogeno).
Nel gruppo di aminoacidi polari senza carico ci sono anche la serina, la treonina, la cisteina e la glutammina. Tutti questi sono composti "Zwitterionics", Dal momento che hanno un gruppo polare nella sua catena R che contribuisce con la neutralizzazione dei carichi.
Tutti gli aminoacidi polari senza carico non sono ionizzabili in pH vicino a 7 (neutro), cioè non hanno cariche positive o negative. Tuttavia, nei media acidi e di base, i sostituenti sono ionizzati e acquisiscono un peso.
Stereochimica
Il carbonio centrale o il carbonio α degli aminoacidi è un carbonio chirale, quindi ha quattro diversi sostituenti uniti, il che provoca almeno due stereoisomeri distinguibili per ogni aminoacido.
Gli stereoisomeri sono immagini speculatori di una molecola che hanno la stessa formula molecolare, ma non sono sovrapponabili tra loro, come le mani (sinistra e destra). Sono indicati con la lettera D o L, poiché sperimentalmente le soluzioni di questi aminoacidi ruotano il piano leggero polarizzato in direzioni opposte.
L'asimmetria generale degli aminoacidi rende la stereochimica di questi composti di grande importanza, poiché ognuno ha proprietà diverse, è sintetizzata e partecipa a percorsi metabolici diversi.
L'asparagina può essere trovata nella forma di asparagina D o l-asparagina, quest'ultima è la natura più frequente. È sintetizzato da L-sintesi e metabolizzato per L-asparaginasi, entrambi gli enzimi sono molto abbondanti nel fegato vertebrato.
Funzioni
La facilità di formare i ponti idrogeno di asparagina lo rende un aminoacido cruciale per la stabilità strutturale delle proteine, poiché può formare ponti idrogeno interni con le catene laterali degli altri aminoacidi che li costituiscono.
Può servirti: 25 esempi di riproduzione asessuataL'asparagina si trova di solito sulla superficie dei tipici mezzi acquosi, stabilizzando la loro struttura.
Molte glicoproteine possono legarsi ai carboidrati o ai carboidrati attraverso un residuo di asparagina, treonina o serina. Nel caso dell'asparagina, un'acetil galattosamina è generalmente unita al gruppo amminico mediante N-glycosilazione.
È importante evidenziare che in tutte le glicoproteine N-glicosilate i carboidrati si legano a questi attraverso un residuo di asparagina che si trova in una regione specifica indicata come asn-x-ser/thr, dove x è qualsiasi aminoacido.
Queste glicoproteine sono assemblate nel reticolo endoplasmatico, dove sono glicosilate mentre vengono tradotte.
Biosintesi
Tutti gli organismi eucariotici assimilano l'ammoniaca e lo trasformano in glutammato, glutammina, carbamil-fosfato e asparagina. L'asparagina può essere sintetizzata dagli intermediari glicolitici, nel ciclo dell'acido citrico (da ossalacetato) o dai precursori consumati nella dieta.
L'enzima di asparagina sintetasi dipende dall'amidotransferasi dalla glutammina e dall'ATP che l'ATP e il pirofosfato inorganico (PPI) sputa e usa l'ammoniaca o la glutammina per catalizzare una reazione di amidazione e convertire l'asparto in asparagine.
Sia i batteri che gli animali hanno un'asparagina sintetasi, tuttavia, nei batteri l'enzima usa lo ione di ammonio come donatore di azoto, mentre nei mammiferi la sintetica sintesi usa la glutammina come donatore principale del gruppo di azoto.
La rottura enzimatica dell'ATP a amp e pirofosfato inorganico (PPI), insieme alla glutammina come donatore del gruppo Amida, sono le principali differenze rispetto alla biosintesi della L-glutamina tra i diversi organismi.
Degradazione
La maggior parte degli studi sul metabolismo dell'asparagina sono stati condotti nelle piante, in considerazione del fatto che inizialmente studi sui mammiferi sono stati ostacolati dalla mancanza di metodologie abbastanza sensibili per i test di aminoacidi a livello di sistemi più complessi.
La L-asparagina è costantemente idrolizzata nei mammiferi dalla L-asparaginasi per causare acido aspartico e ammonio. È usato per la sintesi di glicoproteine ed è uno dei principali precursori dell'ossalacetato per il ciclo dell'acido citrico.
L'enzima asparaginasi catalizza l'idrolisi dell'asparagina all'aspartato, successivamente l'aspartato viene transaminata con α-cetoglutarato per produrre glutammato e ossalacetato.
Può servirti: epiblastoL'asparagina di sinteta, nota anche come aspartato-amoniaco ligasi, si trova abbondantemente di cellule cerebrali dei mammiferi.
Quando sono percepiti bassi livelli di questo enzima nel corpo, si formano ciò che è noto come "aminoacidopatie", poiché i substrati precursori si accumulano nel citoplasma delle cellule cerebrali.
Alimenti ricchi di asparagina
Le persone che hanno la leucemia linfoblastica acuta di solito hanno carenze rispetto all'enzima di asparagina sintetasi e dipendono dall'asparagina in circolazione, quindi sono raccomandate una dieta in alimenti ricchi di asparagina o dall'approvvigionamento esogeno dello stesso.
Tra i molteplici alimenti con un alto contenuto di asparagina ci sono lei.
Esistono concentrati di asparagina che sono formulati per atleti ad alta competizione, poiché il loro consumo aiuta a rigenerare le proteine che compongono i tessuti.
Inoltre, le persone che hanno un deficit nella sintesi degli aminoacidi ingonano anche queste compresse per evitare i disturbi nel loro sistema nervoso centrale.
L'asparagina è più facile da metabolizzare attraverso la sua forma di asparagina, poiché molti degli enzimi coinvolti nel loro metabolismo non riconoscono la forma D-asparagina e, quindi, non tutte le asparagine ingerite nel cibo sono disponibili per i diversi processi di organismo.
L'abbondante assunzione di asparagina può essere utile, tuttavia non si raccomanda.
Riferimenti
- Cooney, d. A., Capizzi, r. L., & Handschumacher, R. E. (1970). Valutazione del metabolismo dell'asparagina L in Anims and Man. Ricerca sul cancro, 30 (4), 929-935
- Dunlop, p. C., Roon, r. J., E anche, h. L. (1976). Uso di D-asparagina da Saccharomyces cerevisiae. Journal of Bacteriology, 125 (3), 999-1004.
- Kambhampati, s., Ajewole, e., & Marsolais, F. (2017). Progressi nel metabolismo dell'asparagina. In Progressi in botanica Vol. 79 (pp. 49-74). Springer, Cham.
- Kornfeld, r., & Kornfeld, s. (1985). Assemblaggio di oligosaccaridi legati ad asparagina. Revisione annuale della biochimica, 54 (1), 631-664
- Mathews, c. K., & Ahern, K. G. (2002). Biochimica. Pearson Education.
- Nelson, d. L., Lechinger, a. L., & Cox, m. M. (2008). Principi di biochimica Lechinger. Macmillan.
- Yamada, k., Hashizume, d., Shimizu, t., & Yokoyama, s. (2007). L-asparagina. Atto cristallografico Sezione E: Struttura Rapporti online, 63 (9), 3802-3803.
- « Caratteristiche dell'acido glutammico, funzioni, biosintesi
- Caratteristiche delle mani, struttura, funzioni »

