Struttura di Anisol, proprietà, nomenclatura, rischi e usi
- 4447
- 1358
- Dott. Rodolfo Gatti
Lui anisol o metoxibenzene È un composto organico che consiste in un etere aromatico la cui formula chimica è C6H5Och3. La sua condizione fisica è quella di un liquido incolore, che può presentare colorazioni gialle. È facilmente riconosciuto dal suo odore caratteristico di anice.
È quindi un composto volatile e non molto alte forze di coesione; Caratteristiche abituali negli eteri leggeri, che sono immagazzinati in piccoli contenitori sigillati. In particolare, Anisol è il più semplice dell'etere alucilico alchilico; Cioè quelli con un componente aromatico (AR) e un altro alchil (R), AR-O-R.
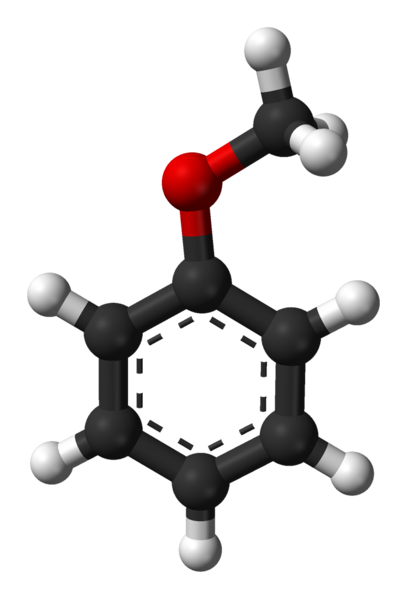
 Molecola di anisol. Fonte: Ben Mills via Wikipedia.
Molecola di anisol. Fonte: Ben Mills via Wikipedia. Gruppo c6H5- viene a denotare AR e -Ch3 A r, così avendo c6H5-O-ch3. L'anello aromatico e la presenza di -och3 Come gruppo sostituente chiamato Metoxi, l'anisol dà una nucleofilia superiore a quella di benzene e nitrobenzene. Pertanto, funge da molecola intermedia per la sintesi di composti con attività farmacologica.
Il suo odore caratteristico di anice è stato usato per aggiungere Anisol ai prodotti cosmetici e igienici che richiedono una piacevole fragranza.
[TOC]
Struttura di anisol
Nell'immagine superiore la struttura molecolare di Anisol è mostrata mediante un modello di sfere e barre. L'anello aromatico è apprezzato, i cui carboni sono SP2 e quindi è piatto, come un foglio esagonale; E collegato a lui, è il gruppo Metoxi, il cui carbonio è SP3, e i suoi idrogeni sono sopra o sotto il piano dell'anello.
L'importanza del gruppo -och3 Nella struttura va oltre quello di rompere con la geometria piatta della molecola: le dà polarità e, di conseguenza, la molecola apolare benzene acquisisce un momento di dipolo permanente.
Momento dipolare
Questo momento di dipolo è dovuto all'atomo di ossigeno, che attira le densità elettroniche dell'anello aromatico e metilico. Grazie a questo, le molecole di Anisol possono interagire le forze di mezzo dipolo; Anche se, non ha possibilità di formare ponti idrogeno, perché è un etere (ROR non ha ossigeno collegato).
Può servirti: cloruro di sodio (NaCl)Il suo punto di ebollizione elevato (154 ° C), certifica sperimentalmente le forti interazioni intermolecolari che regolano il suo liquido. Allo stesso modo, le forze di dispersione di Londra sono presenti, dipendenti dalla massa molecolare e dalle interazioni π -π tra gli anelli stessi.
Cristalli
La struttura di Anisol, tuttavia, non gli permette.F = -37ºC). Ciò può anche essere dovuto al fatto che quando le distanze intermolecolari sono ridotte, le repulsioni elettrostatiche tra anelli aromatici vicini sono molto forti.
Pertanto, e secondo gli studi cristallografici, le molecole di anisol nei cristalli a una temperatura di -173 ° C non possono essere ordinate in modo tale che gli anelli siano affrontati; Cioè, i suoi centri aromatici non si allineano tra loro, ma un gruppo -och3 È su o sotto un anello vicino.
Proprietà
Aspetto fisico
Fluido incolore ma che può presentare toni di paglia color lieve.
Odore
Ha un odore leggermente simile ai semi di anice.
Gusto
Dolce; Tuttavia, è moderatamente tossico, quindi questo test è pericoloso.
Massa molecolare
108.140 g/mol.
Densità
0,995 g/ml.
Densità del vapore
3.72 (in relazione all'aria = 1).
Punto di fusione
-37ºC.
Punto di ebollizione
154ºC.
punto di accensione
125 ° C (tazza aperta).
Temperatura di autorezione
475ºC.
Sostanza vischiosa
0,778 cp a 30ºC.
Tensione superficiale
34,15 Dins/cm a 30ºC.
Rifrazione indica
1.5179 a 20 ° C.
Solubilità
Scarsamente solubile in acqua (circa 1 mg/ml). In altri solventi, come acetone, eteri e alcoli, è comunque molto solubile.
Nucleofilia
L'anello aromatico di Anisol è ricco di elettroni. Questo perché l'ossigeno, nonostante sia un atomo molto elettronegativo, contribuisce con gli elettroni della loro nuvola π per demociare loro attraverso l'anello in numerose strutture di risonanza. Di conseguenza, più elettroni viaggiano nel sistema aromatico e quindi aumenta la sua nucleofilia.
Può servirti: alcol candole: struttura, formula, proprietà e usiSperimentalmente l'aumento della nucleofilia è stato dimostrato confrontando la sua reattività, di fronte a sostituzioni elettrofili aromatiche, con quella del benzene. Pertanto, è evidenziato il notevole effetto del gruppo -och3 Sulle proprietà chimiche del composto.
Va anche notato che le sostituzioni elettrofile si verificano in posizioni adiacenti (-orto) e opposte (per) al gruppo Metoxi; Cioè, questo è il regista orto-per.
Reattività
La nucleofilia dell'anello aromatico di Anisol ti consente già di intravedere come sia la sua reattività. Le sostituzioni possono avvenire sul ring (favorite dalla sua nucleofilia) o nello stesso gruppo Metaxi; In quest'ultimo il collegamento O-ch è rotto3 Per sostituire il -ch3 Per un altro gruppo alquilicico: O-alquilación.
Pertanto, in un processo di alchilazione, Anisol può accettare un gruppo R (frammento di un'altra molecola) che sostituisce una H del suo anello (C-Living) o sostituendo il CH3 Dal tuo gruppo Metoxi. La seguente immagine illustra ciò che viene appena detto:
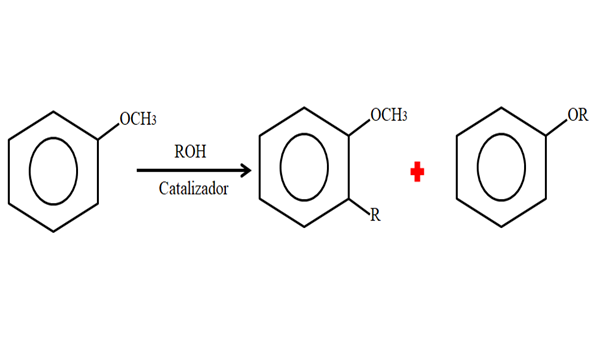 Alchilazione anisol. Fonte: Gabriel Bolívar.
Alchilazione anisol. Fonte: Gabriel Bolívar. Nell'immagine il gruppo r si trova in posizione -ori, ma può anche essere nella posizione -per di fronte a -och3. Quando si verifica O -alquilación, si ottiene un nuovo etere con un altro gruppo -o.
Nomenclatura
Il nome "Anisol" è il più noto e accettato, molto probabilmente derivato dal suo odore simile all'anice. Tuttavia, il nome "Metoxibenzene" è abbastanza specifico, poiché stabilisce una volta che la struttura e l'identità di questo etere aromatico; Questo è il nome governato dalla nomenclatura sistematica.
Un altro nome meno usato, ma ugualmente valido, è il "fenil metil etere", che è governato dalla nomenclatura tradizionale. Questo è forse il nome più specifico di tutti, poiché indica direttamente quali sono le due parti strutturali dell'etere: fenil-o-metil, c6H5-O-ch3.
Rischi
Gli studi medici non sono ancora stati in grado di dimostrare i possibili effetti mortali dell'anisol sul corpo a basse dosi. Tuttavia, come quasi tutte le sostanze chimiche, produce irritazioni quando troppo tempo è esposto e in concentrazioni moderate per la pelle, la gola, i polmoni e gli occhi.
Può servirti: legge di amagat: spiegazione, esempi, eserciziInoltre, a causa della nucleofilia del suo anello, una parte di esso è metabolizzata e quindi è biodegradabile. In effetti, a seguito di questa proprietà, le simulazioni hanno dimostrato che non si concentra su ecosistemi acquosi da quando i suoi organismi lo degradano per la prima volta; E quindi, fiumi, laghi o mari possono accumulare Anisol.
Nei suoli, data la sua volatilità, evapora rapidamente e viene trascinato dalle correnti d'aria; Pertanto, né le masse vegetali né le piantagioni influenzano considerevolmente.
D'altra parte, atmosfericamente reagisce con i radicali liberi e quindi non rappresenta un rischio di inquinamento atmosferico che respiriamo.
Applicazioni
Sintesi organica
Dall'anisol altri derivati possono essere ottenuti mediante sostituzione elettrofila aromatica. Ciò consente di essere usato come intermediario per la sintesi di farmaci, pesticidi e solventi, che hanno desiderato aggiungere le loro caratteristiche. Le rotte sintetiche possono consistere principalmente.
Fragranze
Oltre al suo utilizzo per la sintesi organica, può essere usato direttamente come additivo per creme, unguenti e profumi, incorporando le fragranze anti.
Riferimenti
- Morrison, r. T. e Boyd, r, n. (1987). Chimica organica. 5a edizione. Editoriale Addison-Wesley Inter-American.
- Carey f. A. (2008). Chimica organica. (Sesta edizione). Mc Graw Hill.
- Graham Solomons t.W., Craig b. Frigorifero. (2011). Chimica organica. Ammine. (10a edizione.). Wiley Plus.
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Anisole. Database PubChem, CID = 7519. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2019). Anisole. Recuperato da: in.Wikipedia.org
- Pereira, Cynthia C. M., De la Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Phaselation liquida di anisole e fenolo catalizzato dal niobio fosfato. Journal of the Brasilian Chemical Society, 21 (2), 367-370. Dx.doi.org/10.1590/S0103-50532010000200025
- Seidel r. W. e Goddard R. (2015). Anisole a 100 K: la prima determinazione della struttura cristallina. CrystalGr C Strutch Chem Act. Agosto; 71 (Pt 8): 664-6. Doi: 10.1107/S2053229615012553
- Formulazione chimica. (2018). Metoxibenzene. Recuperato da: formulazione Quimica.com
- « Formazione anione, caratteristiche e tipi
- Formazione di cationi, differenze con l'anione ed esempi »

