Formazione di cationi, differenze con l'anione ed esempi

- 1910
- 330
- Brigitta Ferrari
UN catione È una specie chimica che ha una carica positiva. I due tipi di ioni esistenti sono per l'anione. Il suo carico è il prodotto di una carenza di elettroni nell'atomo, che fa sì che i protoni core esercitino una maggiore attrazione. Per ogni elettrone che perde un atomo neutro, il carico positivo viene aumentato in un'unità.
Se un atomo perde un elettrone e, quindi, il numero di protoni è maggiore di uno, allora il suo carico positivo sarà +1; Se perdi due elettroni, il carico sarà +2 e così via. Quando un catione ha un carico di +1 si dice che sia monovalente; D'altra parte, se detto carico è maggiore di +1, si dice che il catione sia versatile.
 Idronio ion, uno dei cationi più semplici. Fonte: Gabriel Bolívar.
Idronio ion, uno dei cationi più semplici. Fonte: Gabriel Bolívar. Nell'immagine superiore viene mostrato al catione h3O+, chiamato ione idronio. Come si può vedere, ha a malapena un carico +1, secondo un catione monovalente.
I cationi sono specie importanti, poiché esercitano una forza elettrostatica con il loro ambiente e le molecole. Hanno un'alta interazione con l'acqua, il liquido che li idrata e li trasporta nei terreni bagnati, quindi raggiungono le radici delle piante e devono essere utilizzati per le loro funzioni fisiologiche.
[TOC]
Come si forma un catione?
È stato detto che quando un atomo perde un elettrone, il suo maggior numero di protoni, in relazione agli elettroni, esercita una forza di attrazione che si traduce in un carico positivo. Ma come può verificarsi la perdita di elettroni? La risposta dipende dalla trasformazione avvenuta nelle reazioni chimiche.
Va notato che la presenza di un atomo con carico positivo non implica necessariamente la formazione di un catione. In modo che possa essere considerato come tale, non dovrebbe esserci un atomo con un carico formale negativo che neutralizza. Altrimenti, ci sarebbero attrazioni e repulsioni all'interno dello stesso composto e sarebbero neutrali.
Può servirti: solfato di calcio (CASE4): struttura chimica, proprietà, usiCariche formali e più collegamenti
Gli atomi elettronegativi attirano gli elettroni dei loro legami covalenti verso di loro. Sebbene gli elettroni siano condivisi allo stesso modo, c'è un punto in cui avranno parzialmente meno elettroni rispetto alla loro configurazione basale; Questo è, quello dei loro atomi liberi senza essere collegati ad altri elementi.
Quindi, questi atomi elettronegativi inizieranno a sperimentare una carenza di elettroni e, con esso, i protoni dei loro nuclei eserciteranno una forza di maggiore attrazione; Il carico formale positivo nasce. Se esiste solo un carico formale positivo, il composto manifesterà un carico ionico positivo globale; Così è nato il catione.
L'atomo di ossigeno del catione h3O+ È un esempio fedele di quanto sopra. Avendo tre legami O-H, uno in più che nella molecola d'acqua (H-O-H), sperimenta la perdita di un elettrone rispetto al suo stato basale. I calcoli dei carichi formali consentono di determinare quando ciò accade.
Se si assume la formazione di un altro O-H per un momento, il catione divalente verrà ottenuto4O2+. Si noti che il carico bivalente in cima al catione è scritto come segue: il numero ha seguito il simbolo "+"; Allo stesso modo, gli anioni sono processati.
Ossidazione
I metalli sono formatori cationici per eccellenza. Tuttavia, non tutti possono formare legami covalenti (o almeno puramente covalenti). Invece, perdono elettroni per stabilire legami ionici: un carico positivo attira un negativo, unito dalle forze fisiche.
Pertanto, i metalli perdono elettroni per passare da m a mN+, Dove N Di solito è uguale al numero del tuo gruppo nella tabella periodica; Sebbene N Puoi prendere diversi valori interi, che si verificano soprattutto con i metalli di transizione. Questa perdita di elettroni viene eseguita in un tipo di reazione chimica chiamata ossidazione.
Può servirti: alcol terziario: struttura, proprietà, esempiI metalli si ossidano, perdono un elettrone, il numero di protoni dei loro atomi supera quello degli elettroni e di conseguenza mostrano un carico positivo. Perché ci sia ossidazione, ci deve essere un agente ossidante, che riduce o guadagna elettroni persi dai metalli. L'ossigeno è l'agente ossidante più noto di tutti.
Differenze con l'anione
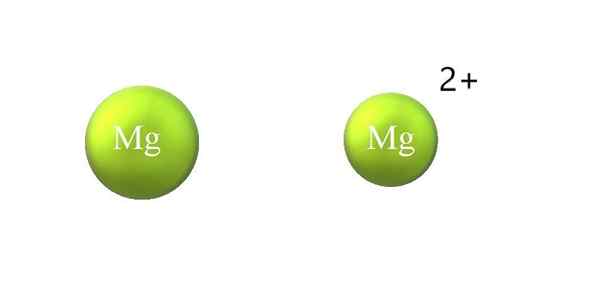 Contrazione del raggio atomico in un catione. Fonte: Gabriel Bolívar.
Contrazione del raggio atomico in un catione. Fonte: Gabriel Bolívar. Di seguito sono riportate le differenze tra un catione e anione:
-Il catione generale è più piccolo dell'anione. L'immagine superiore mostra come il raggio atomico dell'MG viene ridotto perdendo due elettroni e diventando il catione Mg2+; Il contrario si verifica con gli anioni: diventano più ingombranti.
-Ha più protoni degli elettroni, mentre l'anione ha più elettroni che protoni.
-Essendo più piccola, la sua densità di carico è maggiore e quindi ha una maggiore potenza polarizzante; cioè, deforma le nuvole elettroniche degli atomi vicini.
-Un catione si muove nella stessa direzione di quello del campo elettrico applicato, mentre l'anione lo fa nella direzione opposta.
Esempi di cationi più comuni
Monoatomico
I cationi monoatomici provengono principalmente dai metalli (ad eccezione di alcune eccezioni, come H+). Del resto, è estremamente raro considerare un catione derivato da un elemento non metallico.
Si vedrà che molti di loro sono di o versatili e che le magnitudini dei loro carichi concordano con il numero dei loro gruppi nella tabella periodica.
Può servirti: ribulosa-1,5-bifosfato (RUBP): caratteristiche, carbolixation-Li+
-N / a+
-K+
-Rb+
-Cs+
-Fr+
-Ag+
Tutti hanno in comune il carico "1+", che è scritto senza posizionare il numero, e provengono anche dal gruppo 1: metalli alcalini. Inoltre, c'è il Cation AG+, Uno dei metalli di transizione più comuni.
-Essere2+
-Mg2+
-AC2+
-Sig2+
-Ba2+
-RA2+
Questi cationi bivalenti derivano dai rispettivi metalli appartenenti al gruppo 2: metalli alcalinerior.
-Al3+
-Ga3+
-In3+
-Tl3+
-NH3+
Cationi trivalenti del gruppo boro.
Finora gli esempi sono stati caratterizzati da una singola valenza o caricamento. Altri cationi presentano più di una valenza o stato di ossidazione positiva:
-Sn2+
-Sn4+ (lattina)
-Co2+
-Co3+ (cobalto)
-Au+
-Au3+ (oro)
-Fede2+
-Fede3+ (ferro)
E altri metalli, come il manganese, possono ancora avere molte più valenze:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Maggiore è il carico, più piccolo e polarizzante sarà il catione.
Poliiatomico
Senza entrare in chimica organica, ci sono cationi inorganici e polilamici che sono molto comuni nella vita quotidiana; ad esempio:
-H3O+ (Hydronio, già menzionato).
-NH4+ (ammonio).
-NO2+ (Nitronio, presente nei processi di nitrazione).
-Ph4+ (Fosfonium).
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Helmestine, Anne Marie, PH.D. (5 maggio 2019). Definizione ed esempio cation. Recuperato da: Thoughtco.com
- Wyman Elizabeth. (2019). Cation: definizione ed esempio. Studio. Recuperato da: studio.com
- Dummies. (2019). INS positivi e negativi: cationi e anioni. Recuperato da: Dummies.com
- Wikipedia. (2019). Catione. Recuperato da: è.Wikipedia.org
- « Struttura di Anisol, proprietà, nomenclatura, rischi e usi
- Origine archeolitica, caratteristiche, clima, flora e fauna »

