Anidridi acidi come si formano, applicazioni ed esempi

- 2157
- 378
- Lidia Valentini
IL anidridi acidi Sono considerati di grande importanza tra l'ampia varietà di composti di origine organica che esistono. Questi sono presentati come molecole che hanno due gruppi acidi (sostituenti organici la cui formula è RCO-, dove R è una catena di carbonio) unita allo stesso atomo di ossigeno.
C'è anche una classe di anidridi acidi che si trova comunemente: anidridi carbossilici, chiamata perché l'acido iniziale è un acido carbossilico. Per nominare quelli di questo tipo la cui struttura è simmetrica, è necessario effettuare solo una sostituzione di termini.

L'espressione acida deve essere sostituita nella nomenclatura del suo acido carbossilico originale con il termine anidride, che significa "senza acqua", senza alterare il resto del nome della molecola formata. Questi composti possono anche essere generati in base a uno o due gruppi di acidi di altri acidi organici, come l'acido fosfonico o l'acido solfonico.
Allo stesso modo, gli anidridi acidi possono essere causati in base a un acido inorganico, come l'acido fosforico. Tuttavia, le sue proprietà fisiche e chimiche, le sue applicazioni e altre caratteristiche dipendono dalla sintesi effettuata e dalla struttura dell'anidride.
[TOC]
Come si formano gli anidridi acidi?
Alcuni anidridi acidi provengono da modi diversi, in laboratorio o nel settore. Nella sintesi industriale, l'anidride acetica viene presa come esempio, che è principalmente prodotto dal processo di carbonilazione della molecola di metil acetato.
Un altro esempio di questa sintesi è quello dell'anidride maleico, che viene generato attraverso l'ossidazione della molecola di benzene o butano.
Può servirti: idrossido di zinco (Zn (OH) 2)Tuttavia, nella sintesi di aniidridi acidi in laboratorio, l'enfasi è posta sulla disidratazione degli acidi corrispondenti, come la produzione dell'anidride ethanica, in cui due molecole di acido etaico sono disidratate per dare origine al composto menzionato.
Può anche verificarsi una disidratazione intramolecolare; Cioè, all'interno della stessa molecola di un acido con due gruppi carbossilici (o dicarbossilici), ma se si verifica il contrario e un'anidride acida subisce l'idrolisi, la rigenerazione degli acidi che lo ha originato si verifica.
Anidridi acidi i cui sostituenti acilici sono uguali, mentre negli anidridi di questo tipo considerati misti, queste molecole sono diverse sono diverse.
Tuttavia, queste specie vengono anche generate quando si verifica una reazione tra un halur acido (la cui formula generale è un (rcox)) con una molecola carbossilato (la cui formula generale è r'cooo-))))))). [2]
Formula generale
La formula generale degli anidridi acidi è (RC (O))2Oppure, che è meglio osservato nell'immagine posizionata all'inizio di questo articolo.
Ad esempio, per l'anidride acetica (dall'acido acetico) la formula generale è (CH3CO)2Oppure, scrivendo in modo simile per molti altri anidridi acidi simili.
Come affermato sopra, questi composti hanno quasi lo stesso nome dei loro acidi precursori e l'unica cosa che cambia è il termine acido per anidride, poiché le stesse regole di numerazione di atomi e sostituenti devono essere seguiti per avere successo con la loro nomenclatura.
Applicazioni
Gli anidridi acidi hanno molte funzioni o applicazioni a seconda del campo che viene studiato, poiché hanno un'elevata reattività, possono essere reagenti precursori o far parte di molte reazioni importanti.
Può servirti: pirolisiUn esempio di ciò è l'industria, in cui l'anidride acetica è prodotta in grandi quantità perché è la struttura più semplice che può essere isolata. Questa anidride è usata come un importante reagente organico, come gli esteri di acetato.
Uso industriale
D'altra parte, l'anidride Maleico è mostrata con una struttura ciclica, utilizzata nella produzione di copertura per uso industriale e come precursore di alcune resine attraverso il processo di copolimeterizzazione con molecole di streto. Inoltre, questa sostanza funge da dienofilo quando viene eseguita la reazione di Diels-Alder.
Allo stesso modo, ci sono composti che hanno due molecole di anidridi acidi nella loro struttura, come l'etistarbossilica o la diadride dianidrid.
Oltre a questi, esiste un'anidride mista chiamata 3'-fosfoadenosín-5'-fosfosolfato, da acidi fosfori e solforici, che costituisce il coenzima più comune nelle reazioni di trasferimento di solfato biologico.
Esempi di anidridi acidi
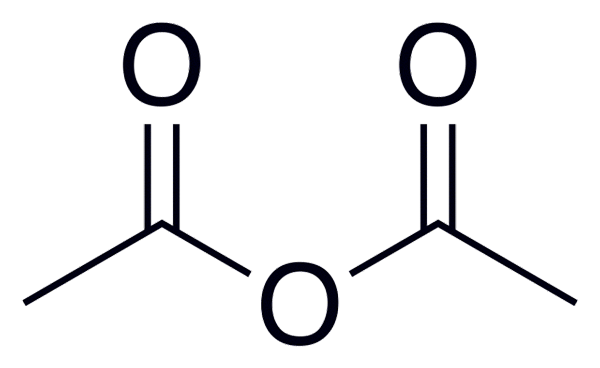 Anidride acetica
Anidride acetica Di seguito è riportato un elenco con i nomi di alcuni anidridi acidi, per fornire alcuni esempi di questi importanti composti nella chimica organica che possono formare composti di struttura lineare o anelli di diversi membri:
- Anidride acetica.
- Anidride propanoica.
- Anidride benzoica.
- Anidride maleico.
- Anidride succinica.
- Anidride ftalica.
- Naftalente -tracarbossilica dianidride.
- Dianidride etitertarbossilica.
- BenzochinonteterArbossilic Dianidride.
Proprio come si formano questi anidridi con ossigeno, vengono somministrati altri composti in cui un atomo di zolfo può sostituire l'ossigeno sia nel gruppo carbonilico che nell'ossigeno centrale, come: ad esempio:
Può servirti: acetanilide (c8h9no)- Anidride tioacetica (scegli3C (s)2O)
C'è anche il caso di due molecole acide che formano collegamenti con lo stesso atomo di zolfo; Questi composti sono chiamati TiOanidridi, vale a dire:
- Tioanidride acetica ((CH3CO))2S)
Riferimenti
- Wikipedia. (2017). Wikipedia. Recuperato da.Wikipedia.org
- Johnson, a. W. (1999). Invito alla chimica organica. Recuperato dai libri.Google.co.andare.
- Acton, q. A. (2011). Acidride Acidride Hydrolas: progressi nella ricerca e nell'applicazione. Recuperato dai libri.Google.co.andare
- Bruckner, r., E Harmata, M. (2010). Meccanismi organici: reazioni, stereochimica e sintesi. Recuperato dai libri.Google.co.andare
- Kim, J. H., Gibb, h. J., e Iannucci, a. (2009). Anidridi di acido ciclico: aspetti della salute umana. Recuperato dai libri.Google.co.andare

