Tipi di batterie, caratteristiche e reazioni

- 1156
- 282
- Dott. Rodolfo Gatti
Sul mercato puoi diventare diverso Tipi di batterie con le sue carattere Proprio. Le batterie, che non sono altro che le celle voltaiche, forniscono al consumatore il vantaggio di prendere con qualsiasi luogo (a condizione che le condizioni non siano drastiche).
Generalmente le batterie possono essere acquistate isolate; Ma sono anche attaccati l'uno all'altro in serie o paralleli, il cui set è quello che chiamano batterie. E quindi a volte i termini "batterie" e "batterie" sono generalmente usati indiscriminatamente, anche se non sono gli stessi.
 Batterie alcaline: uno dei tipi di batterie più noti
Batterie alcaline: uno dei tipi di batterie più noti Le batterie possono avere innumerevoli colori, forme e dimensioni, come possono essere fatti di altri materiali. Inoltre, e soprattutto, la loro struttura interna, in cui vengono sviluppate reazioni chimiche che generano elettricità, servono a differenziarle l'una dall'altra.
Ad esempio, tre batterie alcaline, una delle più comuni sono mostrate nell'immagine superiore. Il termine alcalino si riferisce al fatto che il mezzo in cui si verifica il rilascio e il flusso di elettroni è di base; cioè, ha un pH maggiore di 7 e prevalgono gli anioni OH- e altre cariche negative.
[TOC]
Classificazione Pilas
Prima di affrontare alcuni dei diversi tipi di batterie, è necessario sapere che questi sono classificati a livello globale come primario o secondario.
- Batterie primarie
Le batterie primarie sono quelle che una volta consumate, devono essere scartate o riciclate, poiché la reazione chimica su cui è sostenuta la corrente elettrica è irreversibile. Pertanto, questi non possono essere ricaricati.
Sono utilizzati principalmente nelle applicazioni in cui non è pratico ricaricare l'energia elettrica; come su dispositivi militari, nel mezzo del campo di battaglia. Sono anche progettati per attrezzature che consumano poca energia, in modo che durino più a lungo; Ad esempio, telecomandi o console portatili (Gameboy, Tetris e Tamagotchi).
Le batterie alcaline, per citare un altro esempio, appartengono anche al tipo primario. Di solito hanno forme cilindriche, sebbene ciò non implichi che le batterie cilindriche non possano essere secondarie o ricaricabili.
- Batterie secondarie
A differenza delle batterie primarie, quelle secondarie possono essere ricaricate una volta che hanno esaurito l'energia.
Questo perché le reazioni chimiche che si verificano al suo interno sono reversibili e, quindi, dopo aver applicato una certa tensione, fa nuovamente il reagente che le specie del prodotto siano diventate reagenti.
Alcune batterie secondarie (chiamate batterie) sono generalmente piccole, così come primarie; Tuttavia, sono assegnati a dispositivi che consumano più energia e per i quali l'uso di batterie primarie sarebbe economicamente ed energicamente. Ad esempio, le batterie dei telefoni cellulari contengono batterie secondarie.
Inoltre, le batterie secondarie sono progettate per attrezzature o circuiti di grandi dimensioni; Ad esempio, le batterie per auto, che sono composte da diverse batterie o celle voltaiche.
Di solito sono più costosi delle batterie e delle batterie primarie, ma per usi a lungo termine finiscono per essere un'opzione più appropriata ed efficace.
- Altri aspetti
Le batterie sono classificate in primario o secondario; Ma commercialmente o popolarmente, di solito sono classificati in base alla forma (cilindrica, rettangolare, bottoni), al dispositivo destinato (telecamere, veicoli, calcolatori), ai loro nomi (AA, AAA, C, D, N, A23, ecc. .) E ai suoi codici IEC e ANSI.
Può servirti: piridina: struttura, proprietà, usi, tossicità, sintesiInoltre, caratteristiche come la sua tensione (da 1,2 a 12 volt), nonché la loro vita e i prezzi utili, sono responsabili di conferire una determinata classificazione agli occhi del consumatore.
Elenco dei tipi di pile
- Batterie di Zinc di carbonio
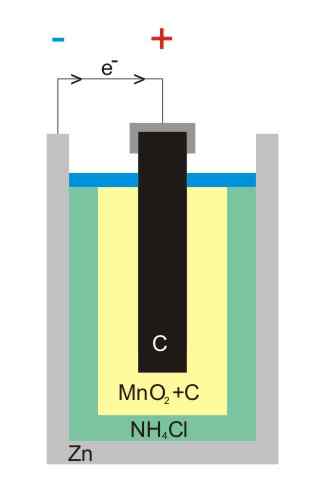 Illustrazione della batteria di zinco-carbonio
Illustrazione della batteria di zinco-carbonio Le batterie al zinco di carbonio (note anche come celle Leclanché o Salinas Pilas) sono una delle più primitive e sono attualmente considerate quasi in disuso davanti ad altre batterie; Soprattutto, di fronte alle batterie alcaline, che sebbene siano un po 'più costose, hanno una vita e le tensioni principali.
Come suggerisce il nome, i suoi elettrodi sono costituiti da una lattina di zinco e un'asta di grafite, corrispondente rispettivamente all'anodo e al catodo.
Nel primo elettrodo, l'anodo origina gli elettroni per ossidazione dello zinco metallico. Questi elettroni viaggiano quindi un circuito esterno che alimenta il dispositivo con elettricità e quindi finiscono nel catodo di grafite, dove il ciclo viene completato quando il biossido di manganese viene ridotto in cui è immerso.
Reazioni
Le equazioni chimiche per le reazioni che si verificano negli elettrodi sono:
Zn (s) → Zn2+(AC) + 2E- (Anodo)
2 MNO2(s) + 2e- + 2 NH4Cl (AC) → Mn2O3(s) + 2 NH3(AC) + H2O (l) + 2 cl- (AC) (catodo)
Queste batterie sono molto simili all'alcalina: entrambe sono cilindriche (come quelle dell'immagine). Tuttavia, le batterie al zinco di carbonio possono essere distinte se le caratteristiche etichettate all'estero vengono lette in dettaglio o se il codice IEC è preceduto dalla lettera R. La sua tensione è 1,5 V.
- Batterie alcaline
Le batterie alcaline sono molto simili a quelle del tipo di zinco di carbonio, con la differenza che il mezzo in cui gli elettrodi contengono anioni OH-. Questo mezzo è costituito da forti elettroliti di idrossido di potassio, KOH, che contribuisce all'OH- che partecipano e "collaborano" nella migrazione degli elettroni.
È disponibile in diverse dimensioni e tensioni, sebbene il più comune è 1,5 V. Sono forse le batterie più conosciute sul mercato (Duracell, per esempio).
Le reazioni che si verificano nei loro elettrodi sono:
Zn (s) + 2oh-(AQ) → ZnO (S) + H2O (l) + 2e- (Anodo)
2mn2(s) + H2O (l) + 2e- → Mn2O3(s) + 2oh-(aq) (catodo)
All'aumentare della temperatura, le reazioni si verificano più velocemente le batterie vengono scaricate. È interessante notare che sono state eseguite voci popolari per metterli nel congelatore per aumentare il loro tempo di vita; Ma, durante il raffreddamento, il suo contenuto può subire possibili solidificazioni che portano ulteriori difetti o rischi con loro.
Mercurio
 Probabile batteria di mercurio, che può essere confusa con la batteria dell'ossido d'argento. Fonte: MultiTherry [CC0].
Probabile batteria di mercurio, che può essere confusa con la batteria dell'ossido d'argento. Fonte: MultiTherry [CC0]. Le batterie al mercurio sono molto caratteristiche a causa della loro peculiare vergogna dei bottoni d'argento (immagine superiore). Quasi tutti li riconoscerebbero a prima vista. Sono anche alcalini, ma il loro catodo incorpora, oltre al biossido di grafite e manganese, ossido di mercurio, HGO; che, dopo aver ridotto, diventa mercurio metallico:
Zn (s) + 2oh-(AC) → ZnO (S) + H2O (l) + 2e-
Hgo (s) + h2O + 2e- → Hg (S) + 2OH-
Può servirti: ossido di magnesio: struttura, proprietà, nomenclatura, usiNota come in queste reazioni cellulari gli anioni OH vengono consumati e rigenerati-.
Essendo piccole batterie, è destinato a piccoli artefatti, come orologi, calcolatori, controlli giocattoli, ecc. Chi ha usato uno di questi oggetti avrà notato che non è necessario cambiare le batterie per quasi una "eternità"; che avrebbe 10 anni, approssimativamente.
Ossido d'argento
 Batterie di ossido d'argento. Fonte: Lukas A, CZE [dominio pubblico].
Batterie di ossido d'argento. Fonte: Lukas A, CZE [dominio pubblico]. Il principale difetto delle batterie al mercurio è che quando vengono scartate rappresentano un grave problema per l'ambiente, a causa delle caratteristiche tossiche di detto metallo. Forse questo manca di codici IEC e ANSI. Per le batterie di ossido d'argento, il suo codice IEC è preceduto dalla lettera s.
Uno dei sostituti delle batterie di mercurio corrisponde a quello dell'ossido d'argento, molto più costoso, ma di minor impatto ecologico (immagine superiore). Nei suoi inizi contenevano mercurio per proteggere lo zinco dalla corrosione alcalina.
È disponibile con una tensione di 1,5 V e le sue applicazioni sono molto simili a quelle del Mercury Pila. In effetti, a prima vista entrambe le batterie sembrano identiche; Anche se potrebbero esserci batterie di ossido d'argento molto più grandi.
Le reazioni nei loro elettrodi sono:
Zn (s) + 2oh-(AC) → Zn (OH)2(s) + 2 E-
Ag2O (s) + 2h+(AC) + 2E- → 2ag (s) + h2O (l)
L'acqua subisce successivamente l'elettrolisi, decomposizione su ioni H+ e oh-.
Si noti che al posto del mercurio, è formato nel catodo d'argento in metallo.
- Nickel-Cadmium Pilas (NICAD)
 Batteria NICD. Fonte: Lordider [CC0].
Batteria NICD. Fonte: Lordider [CC0]. Da questo punto vengono considerate batterie o batterie secondarie. Come il mercurio, le batterie al nichel-cadmium sono dannose per l'ambiente (per fauna e salute) da cadmio metal.
Sono caratterizzati dalla generazione di correnti elettriche elevate e possono essere ricaricati un gran numero di volte. In effetti, 2000 volte possono essere ricaricate, il che è uguale a una durabilità straordinaria.
I suoi elettrodi sono costituiti da idrossido di ossido di nichel, bambino (OH), per il catodo e cadmio metallico per l'anodo. La fondazione chimica, in sostanza, rimane la stessa: il cadmio (anziché lo zinco) perde elettroni e il cadmio nio (OH) li vince.
Le reazioni semiceliche sono:
CD (S) + 2OH-(AC) → CD (OH)2(s) + 2e-
2NIO (OH) (S) + 2H2O (l) + 2e- → 2NI (OH)2(s) + oh-(AC)
Oh anioni-, Ancora una volta, provengono dall'elettrolita Koh. Le batterie NICAD, quindi, finiscono per generare idrossidi in metallo di nichel e cadmio.
Sono usati singolarmente o accoppiati in pacchetti (come giallo, immagine superiore). Vengono, quindi, in pacchetti grandi o piccoli. I più piccoli trovano l'uso nei giocattoli; Ma quelli grandi, sono destinati a veicoli aeromobili e elettrici.
- Pilas metallici di nichel-idro (NI-HM)
 Batterie Ni-HM. Fonte: Ramsh Ng di Flickr (https: // www.Flickr.com/foto/Rameshng/5645036051)
Batterie Ni-HM. Fonte: Ramsh Ng di Flickr (https: // www.Flickr.com/foto/Rameshng/5645036051) Un'altra nota batteria o batteria, e che supera NICAD nelle capacità energetiche, è Ni-HM (nichel e idruro metallico). Può arrivare in formato cilindrico (batterie convenzionali, immagine superiore) o accoppiato in una batteria.
Presenti chimicamente quasi le stesse caratteristiche delle batterie NICAD, con la differenza principale basata nel suo elettrodo negativo: il catodo non è cadmio, ma di una lega intermetallica di terre rare e metalli di transizione.
Può servirti: asciugatrice rotante: funzionamento, a cosa serve, parti, applicazioniQuesta lega è responsabile dell'assorbimento dell'idrogeno formato durante il carico, generando un idruro di metallo complesso (da cui la lettera H nel suo nome).
Mentre le batterie Ni-HM forniscono più energia (circa il 40% in più), sono più costose, si indossano più rapidamente e non possono essere ricaricate lo stesso numero di volte delle batterie NICAD; cioè, hanno una vita utile inferiore. Tuttavia, mancano dell'effetto di memoria (perdita delle prestazioni della batteria non essendo completamente dimesso).
È per questo motivo che non dovrebbero essere utilizzati in macchinari che lavorano a lungo termine; Sebbene questo problema sia stato riempito con le batterie LSD-NIHM. Allo stesso modo, le batterie o le batterie Ni-HM hanno caratteristiche termiche molto stabili, essendo operabili in una vasta gamma di temperature senza rappresentare un rischio.
Reazioni
Le reazioni che si verificano nei loro elettrodi sono:
Ni (oh)2(s)+ oh-(AC) ⇌ nio (OH) (s) + H2O (l) + e-
H2O (l) + m (s) + e- ⇌ Oh-(AC)+ MH (S)
- Batterie ion-litio
 Batteria agli ioni di litio di un laptop. Fonte: Kristoferb di Wikipedia.
Batteria agli ioni di litio di un laptop. Fonte: Kristoferb di Wikipedia. Nelle batterie e nelle batterie al litio si basano sulla migrazione degli ioni+, che vengono trasferiti dall'anodo al catodo, prodotto delle repulsioni elettrostatiche dalla carica positiva crescente.
Alcuni possono ricaricare, come batterie per laptop (immagine superiore) e altri, cilindrici e rettangolari (liscio2, Lisocl2 o limousine2) NO.
Le batterie a ioni-litio sono caratterizzate da essere molto leggeri ed energia, il che consente di essere utilizzati in molti dispositivi elettronici, come smartphone e attrezzature mediche. Soffrono anche a malapena dell'effetto della memoria, la loro densità di carico supera quelle delle batterie e delle batterie NICAD e NI-HM e ritardano di più nel download.
Tuttavia, sono molto sensibili alle alte temperature, persino esplodendo; E inoltre, di solito sono più costosi di fronte ad altre batterie. Anche così, sul mercato le batterie al litio sono viste con buoni occhi e molti consumatori le qualificano come le migliori.
- Batterie con piombo acido
 Batteria della batteria per auto carf tipica. Fonte: Tntflash [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)]
Batteria della batteria per auto carf tipica. Fonte: Tntflash [CC BY-SA 3.0 (https: // creativeCommons.Org/licenze/by-sa/3.0)] E infine, i batteri con piombo acido, come suggeriscono il nome, non contengono ioni OH- Ma h+; In particolare, una soluzione concentrata di acido solforico. Le celle voltaiche sono all'interno delle loro scatole (immagine superiore), dove tre o sei di esse possono essere accoppiate in serie, dando una batteria di 6 o 12 V, rispettivamente.
È in grado di generare grandi quantità di carica elettrica e, poiché sono molto pesanti, sono destinati a applicazioni o dispositivi che non possono essere trasportati manualmente; Ad esempio, auto, pannelli solari e sottomarini. Questa batteria acida è la più antica ed è ancora in vigore nel settore automobilistico.
I tuoi elettrodi sono realizzati in piombo: PBO2 Per catodo e piombo metallico spugnoso per anodo. Le reazioni che si verificano in esse sono:
Pb (s) +HSO-4(AQ) → PBSO4(s) +H+(aq) + 2e-
PBO2(S) +HSO-4(aq) + 3h+(aq) + 2e- → PBSO4(s) + 2h2O (l)
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- Odunlade Emmanuel. (24 luglio 2018). Diversi tipi di batterie e applacazioni. Digest del circuito. Recuperato da: circuitDigest.com
- Prba. (S.F.). Tipi di batterie. Recuperato da: PRBA.org
- Isidor Buchman. (2019). Qual è la migliore batteria? Batteria University. Estratto da: Batteryuniversity.com
- Le compagnie McGraw-Hill. (2007). Capitolo 12: Batterie. [PDF]. Recuperato da: Oakton.Edu
- Shapley Patricia. (2012). Tipi di batteria comuni. Università dell'Illinois. Recuperato da: butano.Chimica.Uiuc.Edu
- Atteggiamento ecologico. (22 gennaio 2017). Tipi di batterie: guida completa con batterie e batterie esistenti. Estratto da: ecologico.com
- « Biografia di Tomás Mejía, carriera militare, tiro
- Anidridi acidi come si formano, applicazioni ed esempi »

