Caratteristiche, struttura, funzioni di alfa amilasa
- 5009
- 1571
- Lino Lombardi
IL Alfa Amilasa (α-amilasi) è un enzima amilolitico del gruppo endo amilasas che è responsabile dell'idrolisi dei legami α-1,4 tra i residui di glucosio che costituiscono diversi tipi di carboidrati in natura.
Sistematicamente noto come sistematicamente noto come α-1,4-glucan. Nell'uomo, ad esempio, le amilasi presenti in saliva e quelle secrete dal pancreas sono di tipo α-amilasi.
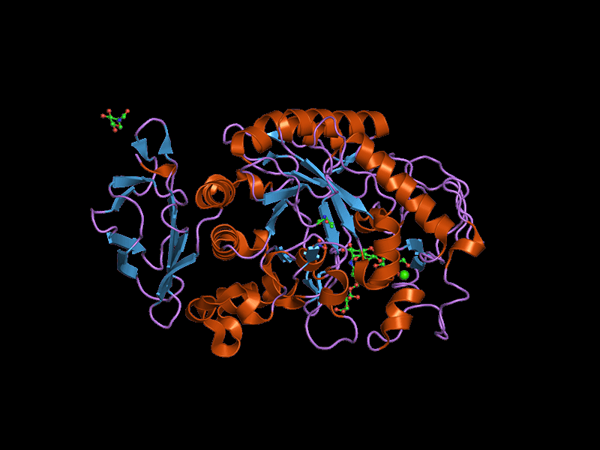
 Struttura del dominio C-terminale dell'Alfa Amilasa Animal (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [dominio pubblico] via Wikimedia Commons) via Wikimedia Commons)
Struttura del dominio C-terminale dell'Alfa Amilasa Animal (fonte: Jawahar Swaminathan e personale MSD presso l'European Bioinformatics Institute [dominio pubblico] via Wikimedia Commons) via Wikimedia Commons) Kuhn, nel 1925, fu il primo a coniare il termine "α-amilasi" in base al fatto che i prodotti dell'idrolisi che catalizzano questi enzimi dispongono di configurazione α. Più tardi, nel 1968 è stato determinato che questi agiscono preferibilmente su substrati di configurazione strutturale lineari e non ramificati.
Come altri enzimi amilolitici, l'α-amilasi è responsabile dell'idrolisi dell'amido e di altre molecole correlate come il glicogeno, producendo polimeri più piccoli composti da unità ripetute.
Oltre alle funzioni fisiologiche che questo enzima ha in animali, piante e microrganismi che lo esprimono, α-amilasi, insieme alle altre classi di amilasi esistenti, rappresentano il 25% degli enzimi utilizzati per il mercato industriale e biotecnologico.
Molte specie di funghi e batteri sono la principale fonte per ottenere le α-amilasi che vengono utilizzate più frequentemente nell'industria e nella sperimentazione scientifica. Ciò è dovuto principalmente alla sua versatilità, al suo facile ottenimento, alla sua semplice gestione e ai bassi costi relativi alla sua produzione.
[TOC]
Caratteristiche
Le α-amilasi trovate in natura possono avere gamme di pH ottimali di pH molto diverso per il suo funzionamento; Ad esempio, ottimale per gli animali e le piante delle α-amilasi sono tra 5.5 e 8.0 unità di pH, ma alcuni batteri e funghi hanno più enzimi alcalini e più acidi.
Può servirti: filogenesiGli enzimi presenti nella saliva e nel pancreas di mammiferi funzionano meglio a pH vicino a 7 (neutro) inoltre, richiedono gli ioni cloruro per raggiungere la loro massima attività enzimatica e sono in grado di unirsi a ioni di calcio bivalenti.
Entrambi gli animali, gli enzimi salivari e pancreatici sono prodotti negli organismi da meccanismi indipendenti che coinvolgono cellule e ghiandole specifiche e che probabilmente non sono correlate agli enzimi presenti nel torrente circolatorio e in altre cavità del corpo.
Sia il pH che la temperatura ottimale per il funzionamento di questi enzimi dipendono notevolmente dalla fisiologia dell'organismo che viene considerata, poiché ci sono microrganismi estremofili che crescono in condizioni molto particolari rispetto a questi e molti altri parametri.
Infine, in termini di regolazione della sua attività, una caratteristica condivisa tra gli enzimi del gruppo di α-amilasi è che queste, come altre amilasi, possono essere inibite da ioni di metalli pesanti come mercurio, rame, argento e piombo.
Struttura
L'α-amilasi è un enzima multidominico che, negli animali e nelle piante, ha un peso molecolare approssimativo di 50 kDa e autori diversi concordano sul fatto che gli enzimi appartenenti a questa famiglia di glicydrolesesi sono enzimi con più di dieci domini strutturali.
Il dominio centrale o il dominio catalitico è molto conservato ed è noto come Domain A, che consiste in una piega simmetrica di 8 fogli β disposti sotto forma di un "barile" che sono circondati da 8 sale alfa, quindi puoi anche trovare in letteratura come (β/α) 8 o "Tim" di tipo barile.
È importante notare che all'estremità C-terminale dei fogli β del dominio A sono i rifiuti di aminoacidi conservati che sono coinvolti nella catalisi e nella giunzione del substrato e che questo dominio si trova nella regione N-terminale di la proteina.
Può servirti: fauna e flora del mare peruvianoUn altro dei domini più studiati di questi enzimi è il cosiddetto ding B, che si distingue tra la lamina β-pedie e l'elica alfa numero 3 del dominio A. Questo svolge un ruolo fondamentale nell'Unione del substrato e del calcio bivalente.
Sono stati descritti ulteriori domini per enzimi α-amilasse, come i domini C, D, F, G, H e I, che si trovano nella parte anteriore o posteriore del dominio A e le cui funzioni non sono conosciute esattamente e dipendono dall'organismo che è studiato.
α-amilasi di microrganismi
Il peso molecolare delle α-amilasi dipende, così come altre caratteristiche biochimiche e strutturali, dall'organismo che viene studiato. Pertanto, le α-amilasi di molti funghi e batteri hanno pesi fino a 10 kDa e fino a 210 kDa.
L'alto peso molecolare di alcuni di questi enzimi microbici è spesso correlato alla presenza di glicosilazione, sebbene la glicosilazione della proteina nei batteri sia piuttosto raro.
Funzioni
Negli animali, le α-amilasi sono responsabili dei primi passi nel metabolismo dell'amido e del glicogeno, in quanto sono responsabili della loro idrolisi a frammenti più piccoli. Gli organi del sistema gastrointestinale incaricato della loro produzione nei mammiferi sono il pancreas e le ghiandole salivari.
Oltre alla sua evidente funzione metabolica, la produzione di α-amilasi prodotte dalle ghiandole salivari di molti mammiferi, attivati dall'azione noradrenalica, è considerata da molti autori come un importante marcatore di stress "psicobiologico" nello stress nel sistema nervoso centrale.
Ha anche funzioni secondarie nella salute orale, poiché la sua attività funziona nell'eliminazione dei batteri orali e nella prevenzione della sua adesione alle superfici orali.
Può servirti: Simpatric Speciation: Concept, Caractistics ed EsempiFunzione principale nelle piante
Nelle piante, le α-amilasi svolgono un ruolo primario nella germinazione dei semi, in quanto sono gli enzimi che idrolizzano l'amido presente nell'endosperma che nutre l'embrione all'interno, elaborano essenzialmente controllati da gibberelin, un fitormone.
Applicazioni industriali
Gli enzimi appartenenti alla famiglia delle α-amilasi hanno più applicazioni in molti contesti diversi: industriali, scientifici e biotecnologici, ecc.
Nelle industrie di trasformazione dell'amido di grandi dimensioni, le α-amilasi sono popolarmente utilizzate per la produzione di glucosio e fruttosio, nonché per la produzione di pane con trame migliorate e con una maggiore capacità leale.
Nel campo biotecnologico, esiste molto interesse per il miglioramento degli enzimi commercialmente utilizzati, al fine di migliorare la loro stabilità e prestazioni in diverse condizioni.
Riferimenti
- Aiyer, p. V. (2005). Amilasi e loro applicazioni. African Journal of Biotechnology, 4(13), 1525-1529.
- Bernfeld, p. (1960). Amilasi, a e b. In Enzimi del metabolismo dei carboidrati (Vol. Io, pp. 149-158).
- Granger, d. A., KIIVIGHAN, K. T., Loro., Gordis, e. B., & Stud, L. R. (2007). A-andlasi salivare nella ricerca biobeivalente. Recenti sviluppi e applicazioni. Ann. N.E. Acade. Sci., 1098, 122-144.
- Monteiro, p., & Oliveira, P. (2010). Applicazione di A-Andlasi microbica nell'industria: una revisione. Brasiliano Journal of Microbiology, 41, 850-861.
- Reddy, n. S., Nimmagadda, a., & Rao, K. R. S. S. (2003). Una panoramica della famiglia microbica α-amore. African Journal of Biotechnology, 2(12), 645-648.
- Salt, w., & Shenker, s. (1976). Amilasi- Il suo significato clinico: una revisione della letteratura. Medicinale, 55(4), 269-289.
- Svensson, b., & MacGregor, e. A. (2001). Relazione tra sequenza e struttura e specificità nella famiglia degli enzimi A-amilasi. Biochimica et Biophysica Acta, 1546, 1-20.
- Thoma, j. A., Spradlin, J. E., & Dygert, s. (1925). Amilasi vegetali e animali. Ann. Chimica., 1, 115-189.
- « Struttura, produzione, secrezione, funzioni di renina
- Urie Bronfenbrenner Biografia, modello ecologico e contributi »

