50 esempi di acidi e basi

- 4224
- 328
- Silvano Montanari
Ce ne sono centinaia Esempi di acidi e basi Ciò può essere trovato in tutti i rami della chimica, ma che nel loro insieme sono separati in due famiglie numerose: inorganica e organica. Gli acidi inorganici sono generalmente noti come acidi minerali, caratterizzati dall'essere particolarmente forti rispetto all'organico.
Gli acidi e le basi sono intesi come sostanze che hanno sapori agricoli o saponáceos, rispettivamente. Entrambi sono corrosivi, sebbene la parola "caustico" sia solitamente usata per basi forti. Nei conti di riepilogo: bruciano e corrono la pelle se la toccano. Le sue caratteristiche nei media solventi hanno programmato una serie di definizioni nel corso della storia.
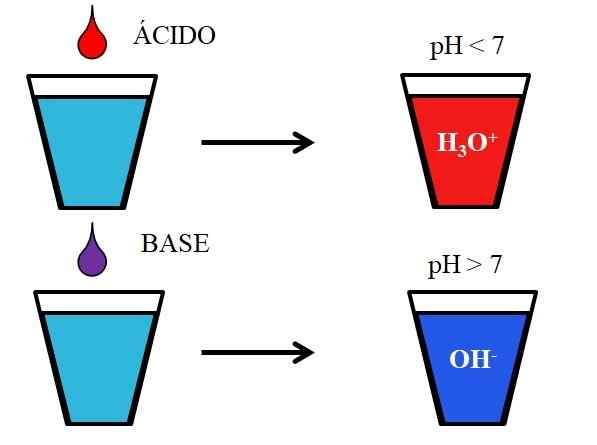 Comportamento di acidi e basi se sciolti in acqua. Fonte: Gabriel Bolívar.
Comportamento di acidi e basi se sciolti in acqua. Fonte: Gabriel Bolívar. L'immagine inferiore mostra il comportamento generico di acidi e basi quando vengono aggiunti o sciolti in un bicchiere con acqua. Gli acidi producono soluzioni con valori di pH inferiori a 7 a causa di ioni idronios, h3O+; Mentre le basi producono soluzioni con pH superiori a 7 a causa di ioni idrossilici (o ossigrillo), OH-.
Se aggiungiamo acido cloridrico, hcl (goccia rossa), al vetro, ci saranno ioni H3O+ e cl- idratato. D'altra parte, se ripetiamo l'esperimento con idrossido di sodio, NaOH (goccia viola), avremo ioni Oh- e na+.
[TOC]
Definizioni

Le caratteristiche, sempre più studiate e comprese, di acidi e basi fissano più di una definizione per questi composti chimici. Tra queste definizioni abbiamo quello di Arrhenius, quello di Bronsted-Lowry, e infine quello di Lewis. Prima di citare gli esempi è necessario averlo chiaro.
Arrhenius
Acidi e basi, secondo Arrhenius, sono quelli che si dissolvono in acqua producono ioni H3O+ o oh-, rispettivamente. Cioè, l'immagine rappresenta già questa definizione. Tuttavia, di per sé disprezza alcuni acidi o basi troppo deboli per produrre tali ioni. Qui è dove entra la definizione di bronted-lowry.
Può servirti: acidi: caratteristiche ed esempiBronsted-Lowry
Gli acidi Bronsted-Lowry sono quelli che possono donare ioni h+, E le basi sono quelle che accettano queste h+. Se un acido dona molto facilmente+, Significa che è un forte acido. Lo stesso vale per le basi, ma accetta h+.
Pertanto, abbiamo acidi e basi forti o deboli e le loro forze sono misurate in diversi solventi; Soprattutto in acqua, di cui sono stabilite le unità di pH note (da 0 a 14).
Pertanto, un forte acido donerà completamente la sua h+ all'acqua in una reazione del tipo:
Ha + h2O => a- + H3O+
Dove- È la base coniugata di HA. Da qui arriva quindi l'H3O+ presente nel vetro con soluzione acida.
Nel frattempo, una base B debole non proteggerà l'acqua per ottenere la sua rispettiva h+:
B + H2O hb + oh-
Dove hb è l'acido coniugato di b. Questo è il caso di ammoniaca, NH3:
NH3 + H2O nh4+ + OH-
Una base molto forte può donare direttamente ioni oh- Non c'è bisogno di reagire con l'acqua; Come con il Naoh.
Lewis
Infine, gli acidi Lewis sono quelli che vincono o accettano elettroni e le basi di Lewis sono quelle che donano o perdono elettroni.
Ad esempio, la base NH Bronsted-Lowry3 È anche una base di Lewis, poiché l'atomo di azoto accetta un H+ Donendo questo il loro paio di elettroni gratuiti (h3N: h+). Questo è il motivo per cui le tre definizioni non sono in disaccordo tra loro, ma si intrecciano e aiutano a studiare l'acidità e la basicità in uno spettro più ampio di composti chimici.
Può servirti: nichel: storia, proprietà, struttura, usi, rischiEsempi di acidi
Avendo chiarito le definizioni, una serie di acidi sarà menzionata di seguito con le rispettive formule e nomi:
-HF: acido fluoridrico
-HBR: acido bromidrico
-Ciao: acido Yodidrico
-H2S: acido solfidrico
-H2SE: acido seleenidrico
-H2TE: acido teuridrico
Questi sono acidi binari, chiamati anche idraceidi, che appartengono al suddetto acido cloridrico, HCL.
-Hno3: acido nitrico
-Hno2: Acido nitroso
-HNO: acido iponitro
-H2Co3: Acido carbonico
-H2Co2: acido carbonoso, che in realtà è più noto con il nome di acido formico, Hcooh, l'acido organico più semplice di tutti
-H3Po4: acido fosforico
-H3Po3 o h2[HPO3]: acido fosforo, con un legame H-P
-H3Po2 o h [h2Po2]: acido ipofosferico, con due legami H-P
-H2SW4: acido solforico
-H2SW3: Acido solforoso
-H2S2O7: acido disolfurico
-Hio4: acido periódic
-Hio3: Acido yodium
-Hio2: acido iodosio
-Hio: acido ipoyodoso
-H2CRO4: acido cromico
-Hmno4: Acido manganico
-Cap3COOH: acido acetico (aceto)
-Cap3SW3H: acido metanosolfonico
Tutti questi acidi, ad eccezione dei formici e degli ultimi due, sono noti come oxácidos o acidi ternari.
Altri:
-Alcl3: cloruro di alluminio
-Fecl3: cloruro ferrico
-Bf3: Boro trifluoro
-Cationi metallici sciolti in acqua
-Carbocazioni
-H (CHBundiciClundici): Super Acid Carborano
- FSO3H: acido fluorosolfonico
- Hsbf6: Acido fluoroantimonico
- FSO3H · SBF5: Acido magico
Gli ultimi quattro esempi costituiscono i temibili super acidi; composti in grado di disintegrare quasi tutti i materiali con a malapena toccarlo. L'Alcl3 È un esempio di acido Lewis, poiché il centro metallico in alluminio è in grado di accettare elettroni a causa della sua carenza elettronica (non completa il suo ottetto di Valencia).
Può servirti: idrossido di mercurio: struttura, proprietà, usi, rischiEsempi di basi
Tra le basi inorganiche abbiamo idrossidi metallici, come idrossido di sodio, e alcuni hydurn molecolari, come l'ammoniaca già citata. Ecco altri esempi di basi:
-Koh: idrossido di potassio
-Lioh: idrossido di litio
-Rboh: idrossido di rubidio
-CSOH: idrossido di cesio
-Froh: Francia idrossido
-Essere (oh)2: idrossido di beryl
-Mg (oh)2: idrossido di magnesio
-Ca (Oh)2: idrossido di calcio
-Sr (oh)2: Idrossido di stronzio
-Ba (oh)2: idrossido di bario
-Ra (oh)2: radio idrossido
-Faith (Oh)2: idrossido ferroso
-Faith (Oh)3: idrossido ferrico
-Al (Oh)3: idrossido di alluminio
-PB (OH)4: Idrossido plúmbic
-Zn (oh)2: idrossido di zinco
-CD (OH)2: idrossido di cadmio
-Cu (oh)2: Idrossido cupric
-Ti (oh)4: idrossido titanico
-Ph3: fosfina
-Cenere3: Arsina
-Nanh2: sodio amiduro
- C5H5N: piridina
-(Ch3) N: trimetilammina
- C6H5NH2: Fenilammina o anilina
-Nah: idruro di sodio
-KH: idruro di potassio
-Carbanioni
-Li3N: nitruro di litio
-Alcoxidi
-[(Ch3)2Ch]2NLI: diisopropilamide di litio
-Dietinilbenzene anion: c6H4C42- (la base più forte conosciuta finora)
Riferimenti
- Whitten, Davis, Peck e Stanley. (2008). Chimica. (8 ° ed.). Apprendimento del Cengage.
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Naomi Hennah. (10 ottobre 2018). Come insegnare acidi, basi e sali. Recuperato da: edu.RSC.org
- Helmestine, Anne Marie, PH.D. (31 agosto 2019). Formule di acidi e basi comuni. Recuperato da: Thoughtco.com
- David Wood. (2019). Confronta gli acidi e le basi comuni. Studio. Recuperato da: studio.com
- Ross Pomeroy. (23 agosto 2013). Gli acidi più forti del mondo: come il fuoco e il ghiaccio. Recuperato da: RealClearScience.com
- Wikipedia. (2019). Dianion Diethynylbenzene. Recuperato da: in.Wikipedia.org
- « Simboli e formule di diametro, come eliminarlo, circonferenza
- Ecofisiologia Quali studi e applicazioni in animali e verdure »

