Storia iodio, proprietà, struttura, ottenimento, rischi, usi

- 2446
- 365
- Brigitta Ferrari
Lui iodio È un elemento reattivo non metallico che appartiene al gruppo 17 della tabella periodica (alogeni) ed è rappresentato dal simbolo chimico i. In sostanza è un elemento ben noto a livello popolare, dall'acqua iodizzata, all'ormone della tirosina.
A stato solido lo iodio è grigio scuro con una lucentezza metallica (immagine inferiore), in grado di subliminare per produrre un vapore viola che, quando si condensa su una superficie fredda, lascia un residuo scuro. Numerosi e attraenti sono stati esperimenti per dimostrare queste caratteristiche.
 Cristalli di iodio robusti. Fonte: Bungee [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Cristalli di iodio robusti. Fonte: Bungee [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Questo elemento è stato isolato per la prima volta da Bernard Curtois nell'anno 1811, mentre si ottiene composti che servivano da materia prima per la fabbricazione di Saltpeter. Tuttavia, Curtois non ha identificato lo iodio come elemento, merito condiviso da Joseph Gay-Lussac e Humphry Davy. Gay-Lussac ha identificato l'elemento come "iode", un termine che proveniva dalla parola greca "ioides" con cui era designato il colore viola.
Lo iodio elementare, come gli altri alogeni, è una molecola diatomica, formata da due atomi di iodio uniti da un legame covalente. L'interazione di Van der Waals tra le molecole di iodio è la più forte tra gli alogeni. Questo spiega perché lo iodio è alogeno con i più alti punti di scioglimento e ebollizione. Inoltre, è il minimo reagente di alogeni e quello con meno elettronegatività.
Lo iodio è un elemento essenziale che richiede di essere ingerito, poiché è necessario per la crescita del corpo; Sviluppo cerebrale e mentale; Metabolismo in generale, ecc., Raccomandando un'assunzione giornaliera di 110 µg/giorno.
La carenza dello iodio nello stato fetale di una persona è associata alla comparsa del cretinismo, una condizione caratterizzata dal rallentamento della crescita del corpo; così come uno sviluppo mentale e intellettuale insufficiente, strabismo, ecc.
Nel frattempo, una carenza di iodio a qualsiasi età dell'individuo è associata alla comparsa di un gozzo, caratterizzata da un'ipertrofia tiroidea. Il gozzo è una malattia endemica, poiché è limitato a alcune aree geografiche con le proprie caratteristiche alimentari.
[TOC]
Storia
Scoperta
Lo iodio fu scoperto dal chimico francese Bernard Curtois, nell'anno del 1811, mentre lavorava con suo padre nella produzione di Salitre, che richiedeva il carbonato di sodio.
Questo composto è stato isolato dalle alghe che hanno raccolto sulla costa della Normandia e della Bretagna. A tal fine, le alghe bruciate e le ceneri sono state lavate con acqua, distruggendo i rifiuti risultanti con l'aggiunta di acido solforico.
In un'occasione, forse a causa di un errore fortuito, Curtois ha aggiunto un eccesso di acido solforico e si è formato un vapore viola che cristallizzato su superfici fredde, depositando come cristalli scuri. Curtois sospettava di essere in presenza di un nuovo elemento e lo chiamò "sostanza x".
Curtois scoprì che questa sostanza quando miscelata con ammoniaca formava un solido marrone (triaco di azoto) che sfruttava il contatto minimo.
Tuttavia, Curtois aveva dei limiti per continuare le sue ricerche e decise di fornire segni della sua sostanza a Charles Desormes, Nicolas Clément, Joseph Gay-Lussac e André-Marie Ampère, per ottenere la sua collaborazione.
Emergere del nome
Nel novembre 1813, Desormes e Clément rese pubblici la scoperta di Curtois. Nel dicembre dello stesso anno, Gay-Lussac ha affermato che la nuova sostanza potrebbe essere un nuovo elemento, suggerendo il nome di "iode" dalla parola greca "ioides", designato per il viola.
Sir Humphry Davy, che ha ricevuto una parte del campione consegnato ad Ampère da Curtois, ha fatto esperimenti con il campione e ha notato una somiglianza con il cloro. Nel dicembre 1813, la Royal Society di Londra ha partecipato all'identificazione di un nuovo elemento.
Sebbene sia sorta una discussione tra Gay-Lussac e Davy sull'identificazione dello iodio, entrambi hanno riconosciuto che Curtois è stato il primo ad averlo isolato. Nel 1839 Curtois Final.
Usi storici
Nel 1839, Louis Daguerre diede allo iodio il suo primo uso commerciale, per invenzione di un metodo per produrre immagini fotografiche chiamate daguerreotipi, in sottili fogli di metallo.
Nel 1905, il patologo americano David Marine, indagò sulla carenza di iodio in alcune malattie e raccomandò la sua assunzione.
Proprietà fisiche e chimiche
Aspetto
 Sublimazione di cristalli di iodio. Fonte: Ershova Elizaveta [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)]
Sublimazione di cristalli di iodio. Fonte: Ershova Elizaveta [CC BY-SA 4.0 (https: // creativeCommons.Org/licenze/by-sa/4.0)] Lucentezza metallica grigio scuro. Quando sublimano i suoi vapori sono colorazioni viola (immagine superiore).
Peso atomico standard
126.904 u
Numero atomico (Z)
53
Punto di fusione
113,7 ºC
Punto di ebollizione
184,3 ºC
Densità
Temperatura ambiente: 4.933 g/cm3
Solubilità
Nell'acqua si dissolve per causare soluzioni marroni di una concentrazione da 0,03% a 20 ºC.
Questa solubilità aumenta considerevolmente se sono stabiliti ioni ioduro precedentemente disciolti, poiché è stabilito un equilibrio tra l'i- e io2 Per formare la specie anionica i3-, che è risolto meglio dello iodio.
In solventi organici come cloroformio, tetracloruro di carbonio e disolfuro di carbonio, lo iodio si dissolve dando una colorazione viola. Si dissolve anche in composti di azoto, come piridina, chinolina e ammoniaca, per formare una soluzione marrone, di nuovo.
La differenza nelle colorazioni sta nel fatto che lo iodio è sciolto come molecole solvate i2, o mentre il carico trasferisce complessi; Quest'ultimo appare quando si occupano.
Può servirti: solfuro di sodio (Na2s)Odore
Acro, irritante e caratteristico. Soglia di odore: 90 mg/m3 e soglia di odore irritante: 20 mg/m3.
Coefficiente di partizione ottanolo/acqua
Log p = 2.49
Decomposizione
Quando viene riscaldato alla decomposizione, emette un fumo di ioduro di idrogeno e diversi composti di ioduro.
Sostanza vischiosa
2,27 CP a 116 ºC
Triplo punto
386,65 K e 121 kPa
Punto critico
819 K e 11,7 MPa
Calore di fusione
15,52 kJ/mol
Calore di vaporizzazione
41,57 kJ/mol
Capacità calorica molare
54.44 J/(mol · K)
Pressione del vapore
Lo iodio ha una moderata pressione del vapore e quando il contenitore che contiene viene aperto, viene lentamente sublimato a un vapore viola, irritante per gli occhi, il naso e la gola.
Numeri di ossidazione
I numeri di ossidazione per lo iodio sono: -1 (i-), +1 (i+), +3 (i3+), +4 (i4+), +5 (i5+), +6 (i6+) e +7 (i7+). In tutti i sali di ioduro, come il caso del Ki, lo iodio incontra un numero di ossidazione di -1, perché abbiamo l'anione i-.
Lo iodio acquisisce numeri di ossidazione positivi se combinato con più elementi elettronegativi di lui; Ad esempio, nei loro ossidi (i2O5 e io4O9) o composti interologenati (I-F, i-cl e i-br).
Elettronegatività
2,66 su scala Pauling
Energia ionizzata
Primo: 1.008,4 kJ/mol
Secondo: 1.845 kJ/mol
Terzo: 3.180 kJ/mol
Conduttività termica
0.449 W/(M · K)
Resistività elettrica
1.39 · 107 Ω · m a 0 ºC
Ordine magnetico
Diamagnetico
Reattività
Lo iodio è combinato con la maggior parte dei metalli per formare iodidi e anche con elementi non metallici come il fosforo e altri alogeni. Lo ione ioduro è un forte agente riducente, che rilascia spontaneamente un elettrone. L'ossidazione dello ioduro produce una tintura brunastra di iodio.
Lo iodio, al contrario dello ioduro, è un agente ossidante debole; più debole del bromo, del cloro e del fluoruro.
Lo iodio con numero di ossidazione +1 può essere combinato con altri alogeni con numero di ossidazione -1, per originare gli alogenuri di iodio; Ad esempio: bromuro di iodio. È anche combinato con idrogeno per causare ioduro di idrogeno, che dopo la dissoluzione in acqua è chiamato acido iaridico.
L'acido yodhorric è un acido molto forte in grado di formare iodidi mediante reazione con metalli o ossidi, idrossidi e carbonati. Lo iodio ha uno stato di ossidazione +5 in acido yodium (Hio3), che è disidratato per produrre pentossido di iodio (i2O5).
Struttura elettronica e configurazione
- Atomo di iodio e loro collegamenti
 Molecola diatomica di iodio. Fonte: Benjah-BMM27 via Wikipedia.
Molecola diatomica di iodio. Fonte: Benjah-BMM27 via Wikipedia. Lo iodio nel suo stato basale è costituito da un atomo che ha sette elettroni di Valencia, solo uno di essere in grado di completare il suo ottetto e diventare isolectronic con nobile xeno. Questi sette elettroni sono disposti nei loro orbitali 5s e 5p in base alla loro configurazione elettronica:
[Kr] 4D10 5s2 5 p5
Pertanto, gli atomi, mostro una forte tendenza a collegare in modo covalente in modo che ognuno abbia otto elettroni nel suo strato più esterno. Pertanto, due atomi mi avvicino e forma il collegamento I-I, che definisce la molecola diatomica i2 (Immagine superiore); Unità molecolare di iodio nei suoi tre stati fisici in condizioni normali.
Nell'immagine si osserva la molecola I2 rappresentato da un modello di riempimento dello spazio. Non è solo una molecola diatomica, ma anche omonucleare e apolare; Quindi le sue interazioni intermolecolari (i2 - Yo2) Sono governati dalle forze di dispersione di Londra, che sono direttamente proporzionali alla loro massa molecolare e dimensioni dell'atomo.
Questo collegamento I-I, tuttavia, è più debole rispetto a quello degli altri alogeni (F-F, Cl-CL e BR-BR). Ciò è dovuto in teoria alla scarsa sovrapposizione del suo SPO3.
- Cristalli
La massa molecolare dell'i2 Consente alle sue forze dispersive di essere sufficientemente direzionali e forti per stabilire un vetro ortorrombico a pressione ambientale. Il suo alto contenuto di elettroni fa luce promuove le sinfine di transizione energetica, che produce cristalli di iodio.
Tuttavia, quando lo iodio sublima i suoi vapori mostrano una colorazione viola. Questo è già indicativo di una transizione più specifica all'interno degli orbitali molecolari dell'i2 (Quelli con maggiore energia o antienlace).
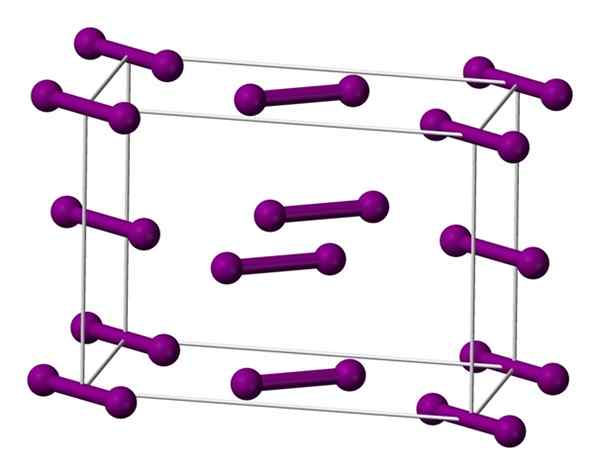 Cellula ortorrombica unitaria centrata sulla base per il cristallo di iodio. Fonte: Benjah-BMM27 [dominio pubblico].
Cellula ortorrombica unitaria centrata sulla base per il cristallo di iodio. Fonte: Benjah-BMM27 [dominio pubblico]. Le molecole che sono mostrate sopra2, rappresentato da un modello di sfere e barre, ordinato all'interno della cella ortorrombica.
Si può osservare che ci sono due strati: quello di seguito con cinque molecole e quello del mezzo con quattro. Si noti che una molecola di iodio si trova alla base della cellula. Il cristallo è costruito periodicamente questi strati nelle tre dimensioni.
Tourndo la direzione parallela ai collegamenti I-I, si è scoperto che gli orbitali di iodio si sovrappongono per generare una fascia di guida, che ritorna a questo elemento un semiconduttore; Tuttavia, la sua capacità di condurre l'elettricità scompare se viene seguita la direzione perpendicolare agli strati.
Distanze di collegamento
Il collegamento I-I sembra essere stato ritardato; E in effetti lo è, perché la lunghezza del suo collegamento aumenta dalle 266 pm (stato gassoso), 272 pm (stato solido).
Ciò può essere dovuto al fatto che in gas le molecole i2 Sono molto distanti, le loro forze intermolecolari sono quasi trascurabili; Mentre sono in solido, queste forze (I-i-i-i) diventano tangibili, attirando gli atomi di iodio di due molecole vicine verso se stesse e secondo la distanza intermolecolare (o interatomica, altrimenti vista).
Può servirti: relazione di chimica con altre scienzeQuindi, quando il vetro di iodio sublimale, il legame I-I si contrae nella fase gassosa, poiché le molecole vicine non esercitano più la stessa forza di attrazione (dispersive) su ciò che. E anche, logicamente, la distanza i2 - Yo2 aumenta.
- Fasi
È stato menzionato sopra che il collegamento I-I è più debole rispetto a quello degli altri alogeni. In fase gassosa a una temperatura di 575 ºC, 1% delle molecole I2 Si disintegrano in individuo e atomi. C'è così tanta energia termica che solo due e ri -join sono separati, e così via.
Allo stesso modo, questa rottura del collegamento può verificarsi se vengono applicate enormi pressioni sui cristalli di iodio. Quando lo comprime troppo (sotto pressione centinaia di migliaia di volte in più rispetto all'atmosfera), le molecole i2 Sono riorganizzati come una fase I monoatomica, e si dice quindi che lo iodio presenta caratteristiche metalliche.
Tuttavia, ci sono altre fasi cristalline, come: ortroma centrale dal corpo.
Dov'è e ottieni
Lo iodio ha una proporzione di peso, in relazione alla crosta terrestre, 0,46 ppm, occupando il posto 61 in abbondanza in esso. I minerali di Yoduro sono scarsi e i depositi di iodio che sono sfruttabili in commercio sono yodatos.
I minerali di iodio trovano nelle rocce ignee con una concentrazione di 0,02 mg/kg a 1,2 mg/kg e nelle rocce magmatiche con una concentrazione di 0,02 mg a 1,9 mg/kg. Può anche essere trovato nel Kimmeridge Lutita, con una concentrazione di 17 mg/kg di peso.
Inoltre, i minerali di iodio si trovano nelle rocce di fosfato con una concentrazione compresa tra 0,8 e 130 mg/kg. L'acqua di mare ha una concentrazione di iodio che varia da 0,1 a 18 µg/L. Alghe, spugne e ostriche marine erano precedentemente le principali fonti di iodio.
Tuttavia, tuttavia, le fonti principali sono Caliche, depositi di nitrati di sodio nel deserto di Atacama (Cile) e Salmuelas, principalmente quelli del campo di gas giapponese a Minami Kanto, a est di Tokyo e nel bacino del campo di gas Anadarko in Oklahoma (Stati Uniti (Stati Uniti (Stati Uniti ).
Il caliche
Lo iodio viene estratto da Iodinus caliche ed è trattato con bisolfito di sodio per ridurlo allo ioduro. Quindi, la soluzione sta reagendo con yodato di recente estratto per facilitare la sua filtrazione. La caliche era la principale fonte di iodio nel diciannovesimo e all'inizio del XX secolo.
La salamoia
Dopo la sua purificazione, la salamoia viene trattata con acido solforico, che produce ioduro.
Questa soluzione di ioduro sta successivamente reagendo con il cloro per produrre una soluzione diluita di iodio, che evapora per mezzo di una corrente d'aria che viene deviata a una torre assorbente di biossido di zolfo, producendo la seguente reazione:
Yo2 + 2 h2O +così2 => 2 hi +h2SW4
Successivamente, il gas di ioduro di idrogeno reagisce con il cloro per rilasciare iodio in uno stato gassoso:
2 hi +cl2 => I2 + 2 HCl
E infine, filtri, purifica e imballaggi di iodio per l'uso.
Carta biologica
- Dieta raccomandata
Lo iodio è un elemento essenziale, poiché interviene in numerose funzioni negli esseri viventi, che sono particolarmente noti negli esseri umani. L'unico modo di ingresso di iodio per l'uomo sono gli alimenti che ingerisce.
La dieta di iodio consigliata varia con l'età. Pertanto un ragazzo di 6 mesi richiede un'assunzione di 110 µg/giorno; Ma dall'età di 14 anni, la dieta raccomandata è di 150 µg/giorno. Inoltre, si noti che l'assunzione di iodio non dovrebbe superare 1.100 µg/giorno.
- Ormoni tiroidei
L'ormone stimolante la tiroide (TSH) è secreto dall'ipofisi e stimola lo iodio con follicoli tiroidei. Lo iodio viene trasportato all'interno dei follicoli tiroidei, noti come colloidi, dove si lega alla tirosina aminoacido per formare monoyodotirosina e diiodotirosina.
Nel colloide follicolare, una monoyodirosina3). D'altra parte, possono essere unite due molecole di diiodotirosina, formando tetrarydotiron (t4). Il t3 e T4 Sono gli ormoni tiroidei così chiamati.
Ormoni t3 e T4 Sono secreti al plasma in cui si legano alle proteine plasmatiche; Tra questi la proteina del trasportatore degli ormoni tiroidei (TBG). La maggior parte degli ormoni tiroidei vengono trasportati in plasma come t4.
Tuttavia, la forma attiva degli ormoni tiroidei è t3, Quindi il t4 Negli "organi bianchi" degli ormoni tiroidei, sperimenta e si trasforma in T3 Per esercitare la tua azione ormonale.
Effetti
Gli effetti dell'azione degli ormoni tiroidei sono multipli, essendo in grado di sottolineare quanto segue: aumento del metabolismo e della sintesi proteica; promozione della crescita del corpo e dello sviluppo del cervello; Aumento della pressione sanguigna e della frequenza cardiaca, ecc.
- Carenza
La carenza di iodio e, quindi, degli ormoni tiroidei, noti come ipotiroidismo, ha numerose conseguenze che sono influenzate dall'età della persona.
Se si verifica la carenza di iodio durante lo stato fetale di una persona, la conseguenza più rilevante è il creatinismo. Questa condizione è caratterizzata da segni come il deterioramento della funzione mentale, il ritardo nello sviluppo fisico, lo strudismo e la maturazione sessuale tardiva.
Può servirti: rame: storia, proprietà, struttura, usi, carta biologicaUna carenza di iodio può indurre un gozzo, indipendentemente dall'età in cui si verifica la carenza. Un gozzo è un eccessivo sviluppo tiroideo, causato da un'eccessiva stimolazione della ghiandola da parte dell'ormone TSH, rilasciato dalla ghiandola pituitaria a seguito della carenza di iodio.
La dimensione eccessiva della tiroide (gozzo) può comprimere la trachea, limitando il passaggio dell'aria attraverso di essa. Inoltre, può causare danni ai nervi laringei che possono avere di conseguenza rum.
Rischi
Un avvelenamento dovuto all'eccessiva apporto di iodio può causare ustioni in bocca, gola e febbre. Anche dolore addominale, nausea, vomito, diarrea, impulso debole e coma.
Un eccesso di iodio produce alcuni dei sintomi osservati in una carenza: esiste un'inibizione della sintesi di ormoni tiroidei, quindi aumenta il rilascio di TSH, che si traduce in un'ipertrofia tiroidea; cioè un gozzo.
Ci sono studi che indicano che l'assunzione eccessiva dello iodio può causare un cancro papillare tiroideo. Inoltre, l'assunzione eccessiva di iodio può interagire con i farmaci limitando la sua azione.
L'assunzione eccessiva di iodio con farmaci antitiroidei, come il metimazolo, usato per trattare l'ipertiroidismo, può avere un effetto additivo e causare ipotiroidismo.
L'angiotensina (ECA) che converte gli inibitori degli enzimi, come Benazepril, sono usati nel trattamento con ipertensione. L'assunzione di una quantità eccessiva di ioduro di potassio aumenta il rischio di ipercalmia e ipertensione.
Applicazioni
Medici
Lo iodio funge da disinfettante di pelle o ferite. Ha quasi un'azione antimicrobica istantanea, penetrando con i microrganismi e interagendo con aminoacidi di zolfo, nucleotidi e acidi grassi, che causano la morte cellulare.
Esercita fondamentalmente la sua azione antivirale sui virus coperti, postulando che attacca la superficie dei virus coperti.
Lo ioduro di potassio in soluzione concentrata, viene utilizzato nel trattamento della tiretossicosi. Viene anche usato per controllare gli effetti di una radiazione di 131Io quando bloccano l'unione dell'isotopo radioattivo alla tiroide.
Lo iodio è usato nel trattamento della cheratite dendritica. Per questo, è esposta la cornea a vapori di acqua satura con iodio, l'epitelio della cornea sta temporaneamente perdendo; Ma c'è un recupero completo di esso in due o tre giorni.
Lo iodio ha anche effetti benefici sul trattamento della fibrosi del seno umano. Allo stesso modo, è stato sottolineato che il 131Potrei essere un trattamento opzionale per il cancro alla tiroide.
Reazioni e azione catalitica
Lo iodio è usato per rilevare la presenza di amido, dando una colorazione blu. La reazione dello iodio con amido viene anche utilizzata per rilevare la presenza di falsi biglietti stampati su carta contenente amido.
Potassio (ii) tetrayodomerCurine, noto anche come reagente di Nessler, è usato nella rilevazione dell'ammoniaca. Allo stesso modo, nel test di iodoformio viene utilizzata una soluzione di iodio alcalino, per mostrare la presenza di metilcetono.
Ioduro inorganico. In una fase del processo, è necessario formare tetrayoduros di questi metalli.
Lo iodio funge da stabilizzatore per Colfonia, olio e altri prodotti in legno.
Lo iodio è usato come catalizzatore nelle reazioni di sintesi organica di metilazione, isomerizzazione e deidrogenazione. Nel frattempo, l'acido iarclorico viene usato come catalizzatore per la produzione di acido acetico nei processi Monsanto e Cativa.
Lo iodio funge da catalizzatore nella condensazione e alposizione di ammine aromatiche, nonché nei processi di solfatizzazione e solfana e per la produzione di gomme sintetiche.
Fotografia e ottica
Silver Yoduro è una componente essenziale del tradizionale film fotografico. Lo iodio viene utilizzato nella produzione di strumenti elettronici come prismi di vetro unici, strumenti ottici polarizzanti e un vetro in grado di trasmettere raggi infrarossi.
Altri usi
Lo iodio è usato nell'elaborazione di pesticidi, anilina e coloranti Phtaleína. Inoltre, viene utilizzato nella sintesi dei coloranti ed è un agente di estinzione. E infine, lo ioduro d'argento funge da nucleo di condensazione del vapore acqueo nelle nuvole, per causare pioggia.
Riferimenti
- SHIVER & ATKINS. (2008). Chimica inorganica. (Quarta edizione). Mc Graw Hill.
- Stuart Ira Fox. (2003). Fisiologia umana. Prima edizione. Modificare. McGraw-Hill Inter-American
- Wikipedia. (2019). Iodio. Recuperato da: in.Wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi e Onoda Mitsuko. (2003). Stretta modulata di iodio solido durante la dissociazione molecolare STI e. Nature Volume 423, Pages971-974. doi.org/10.1038/Nature01724
- Chen l. et al. (1994). Transizioni di fase strutturale di iodio ad alta pressione. Institute of Physics, Sinica Academy, Pechino. doi.org/10.1088/0256-307x/11/2/010
- Stefan Schneider e Karl Christe. (26 agosto 2019). Iodio. Encyclopædia Britannica. Recuperato da: Britannica.com
- Dottore. Doug Stewart. (2019). Fatti per elementi di iodio. Chemicool. Recuperato da: Chemicool.com
- Centro nazionale per le informazioni sulla biotecnologia. (2019). Iodio. Database PubChem. CID = 807. Recuperato da: pubchem.NCBI.Nlm.NIH.Gov
- Rohner, f., Zimmermann, m., Jooste, p., Pandav, c., Caldwell, k., Raghavan, r., & Raiten, D. J. (2014). Biomarcatori della nutrizione per lo sviluppo di revisione. The Journal of Nutrition, 144 (8), 1322S-1342S. Doi: 10.3945/jn.113.181974
- Adomeg. (2019). Iodio. Chimica spiegata. Recuperato da: chimica esplicata.com
- Traci Pedersen. (19 aprile 2017). Fatti sullo iodio. Recuperato da: LiveScience.com
- Megan Ware, RDN, LD. (30 maggio 2017). Tutto quello che devi sapere sullo iodio. Recuperato da: MedicalNewstody.com
- National Institute of Health. (9 luglio 2019). Iodio. Estratto da: SDG.Od.NIH.Gov
- « STORIA, Proprietà, Struttura, Struttura, Ottieni, Rischi, Usi
- Mary Celeste Antecedenti, Eventi, Teories »

